
【题目】2020年化学科学家用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72-)的示意图如图所示,反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。已知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O。下列说法错误的是( )

A.装置①中,a极的电极反应为HS--8e-+4H2O=SO42-+9H+
B.向装置②中加入适量Na2SO4,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6mol H+通过质子交换膜时,装置②中产生0.4mol沉淀
【答案】C
【解析】
A.根据装置图可知,在a电极上HS-失去电子被氧化产生SO42-,由于电解质溶液为酸性,所以a电极反应式为:HS--8e-+4H2O=SO42-+9H+,A正确;
B.在装置②中,Fe电极连接电源正极,作阳极,失去电子发生氧化反应,Fe-2e-=Fe2+,Fe2+具有强的还原性,与废水中的Cr2O72-发生氧化还原反应:6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O;惰性电极连接电源负极,作阴极,发生还原反应:2H++2e-=H2↑,氢离子放电变为氢气逸出,使溶液碱性增强,溶液中的Fe3+、Cr3+变为Fe(OH)3和Cr(OH)3沉淀,可见,Na2SO4电离产生的离子不参加化学反应,其主要作用是增强溶液的导电性,B正确;
C.在装置①中,每产生1mol O2转移4mol电子,在装置②惰性电极上产生的气体为H2,每反应产生1mol H2转移2mol电子,由于同一闭合回路中电子转移数目相等,所以b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)不等,C错误;
D.当装置①中有0.6mol H+通过质子交换膜时,转移0.6mol电子,根据同一闭合回路中电子转移数目相等,装置②中由Fe-2e-=Fe2+可知反应产生0.3mol Fe2+,Fe2+再发生反应:6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O,根据物质转化关系可知0.3mol Fe2+反应转化为0.3mol Fe3+,同时得到0.1mol Cr3+,0.3mol Fe3+产生0.3mol Fe(OH)3沉淀,0.1mol Cr3+产生0.1mol Cr(OH)3沉淀,故装置②中共产生0.4mol沉淀,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型含硅阻燃剂的合成路线如下。请回答相关问题:

(1)化合物A转化为B的方程式为_____,B中官能团名称是______。
(2)H的系统命名为___,H的核磁共振氢谱共有___组峰。
(3)H→I的反应类型是___
(4)D的分子式为______,反应B十I→D中Na2CO3的作用是___。
(5)F由E和环氧乙烷按物质的量之比为1:1进行合成,F的结构简式为___。
(6)D的逆合成分析中有一种前体分子C9H10O2,符合下列条件的同分异构体有___种。①核磁共振氢谱有4组峰;②能发生银镜反应;③与FeCl3发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.溶液与胶体:本质区别是能否发生丁达尔效应
C.常温下可以用铝或铁制容器贮存浓硝酸和浓硫酸
D.用焰色反应鉴别NaCl溶液和![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丙醇和乙酸在浓硫酸作用下,反应制得乙酸丙酯,反应温度为115125℃,反应 装置如图。下列对该实验描述错误的是

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 通常加入过量1—丙醇以提高乙酸的转化率
D. 提纯乙酸丙酯,可用水和氢氧化钠溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
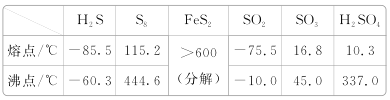
回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
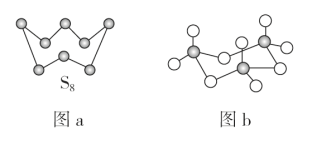
(2)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有___种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+) < c(Cl-)
B.向 NH4Cl 溶液中通 NH3,则 c(![]() ) >c(Cl-) > c(OH-)> c(H+)
) >c(Cl-) > c(OH-)> c(H+)
C.室温下,c(![]() )相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
)相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
D.已知 pKa= -lgKa,pKa(HF)=3.1,pKa(C6H5COOH) = 4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com