
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
【答案】C
【解析】
A、1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,根据盐类越弱越水解的原理分析;
B、据图象分析,pH=13时仍有HCO3-;
C、![]() 为HCO3-的电离平衡常数表达式,其大小只受温度影响;
为HCO3-的电离平衡常数表达式,其大小只受温度影响;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳。
A、根据越弱越水解原理,1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,应有Kb(NH3H2O)>Ka(H2CO3)>Ka2(H2CO3),选项A错误;
B、只要存在碳酸氢根离子就存在HC03-的水解平衡,选项B错误;
C、温度不变,碳酸氢根离子的电离平衡常数不变,选项C正确;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳,所以c(NH4+)+c(NH3H2O)>c(HCO3-)+c(CO32-)+c(H2CO3),选项D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
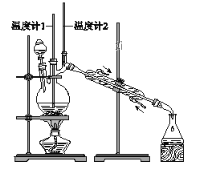
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铅蓄电池的示意图。下列说法正确的是( )
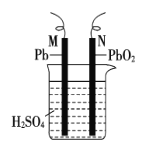
A.充电时,若N连电源正极,则该极生成PbO2
B.放电时,c(H2SO4)不变,两极的质量增加
C.放电时,N为负极,其电极反应式为PbO2+SO![]() +4H++2e-=PbSO4+2H2O
+4H++2e-=PbSO4+2H2O
D.充电时,阳极反应式为PbSO4+2e-=Pb+SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年化学科学家用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72-)的示意图如图所示,反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。已知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O。下列说法错误的是( )

A.装置①中,a极的电极反应为HS--8e-+4H2O=SO42-+9H+
B.向装置②中加入适量Na2SO4,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6mol H+通过质子交换膜时,装置②中产生0.4mol沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠![]() 在溶液中可生成
在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用,但
都具有漂白作用,但![]() 是有毒气体;经测定,
是有毒气体;经测定,![]() 时各组分含量随pH变化情况如图所示
时各组分含量随pH变化情况如图所示![]() 没有画出
没有画出![]() 则下列分析正确的是( )
则下列分析正确的是( )
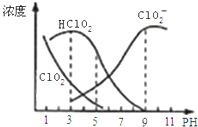
A.亚氯酸钠在酸性条件下较稳定
B.![]() 时,
时,![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
C.pH越大,该漂白剂的漂白性能越好
D.![]() ,
,![]() 时,
时,![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
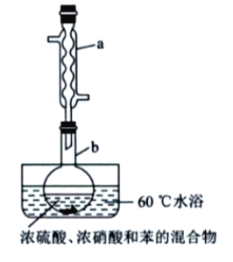
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com