
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
【答案】Fe2O3 Al2O3 D Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- K2SO4和(NH4)2SO4
【解析】
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物甲加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,A Fe2O3,为向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,Al(OH)3受热分解生成B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4,以此来解答。
(1)由上述分析可知,A为Fe2O3,B为Al2O3,
故答案为:Fe2O3;Al2O3;
(2)依据流程分析,向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,
A. NaOH溶液若加入过量会使氢氧化铝沉淀溶解,故A错误;
B. 加稀盐酸不能得到氢氧化铝沉淀,故B错误;
C. 通入二氧化碳不能得到氢氧化铝沉淀,故C错误;
D. 加入氨水可生成氢氧化铝沉淀,且过量氨水不与氢氧化铝反应,故D正确;
故答案为:D;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)反应②中二氧化碳过量,反应生成沉淀和碳酸氢钠,向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,其离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4;固体D可以作为复合性的化学肥料,D中所含物质的化学式为K2SO4和(NH4)2SO4;
故答案为:K2SO4和(NH4)2SO4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如图所示:已知脱氢是氧化反应
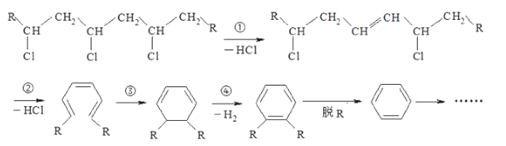
下列说法不正确的是( )
A.聚氯乙烯的单体可由乙烯与HCl加成而得
B.上述反应中①属于消去反应,④属于(脱氢)氧化反应
C.火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D.在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.在![]() 溶液中一定有:
溶液中一定有:![]()
C.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
D.10mL![]()
![]()
![]() 溶液与10mL1
溶液与10mL1![]() 盐酸混合:
盐酸混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为 ,下列与此电池总反应不符的原电池是( )
,下列与此电池总反应不符的原电池是( )
A.铜片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
B.石墨、铁片、![]() 溶液组成的原电池
溶液组成的原电池
C.铁片、锌片、![]() 溶液组成的原电池
溶液组成的原电池
D.银片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)_______0.2 mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_____mol/L;
c(H+)-c(MOH)=__________mol/L
⑵常温下若将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度______NaA的水解程度。(填“>”、“<”、或“=”)
⑶已知:难溶电解质Cu(OH)2在常温下的Ksp = 2×1020,则常温下:某CuSO4溶液中c(Cu2+) = 0.02 mol·L1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为_________。
⑷已知:温度和浓度相等时,氨水的电离程度与醋酸相等。常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列___________(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com