
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.在![]() 溶液中一定有:
溶液中一定有:![]()
C.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
D.10mL![]()
![]()
![]() 溶液与10mL1
溶液与10mL1![]() 盐酸混合:
盐酸混合:![]()
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】已知:(1)![]()
(2)![]()
![]()

(3) ![]()
![]()
![]()
现用如下方法合成高效、低毒农药杀灭菊酯( ):
):

(1)原料A是苯的最简单的同系物,其名称是_____;合成G的反应类型是_____。
(2)写出B的结构简式______________。
(3)写出反应D→E的化学方程式:___________________________________。
(4)杀灭菊酯的核磁共振氢谱共有___________种峰。
(5)氨基酸X与I互为同分异构体,且X是萘(![]() )的一取代物,含有碳碳叁键,X所有可能的结构共有__________种。高聚物Y是由X通过肽键连接而成,Y的结构简式是_________________________(只要求写一种)。
)的一取代物,含有碳碳叁键,X所有可能的结构共有__________种。高聚物Y是由X通过肽键连接而成,Y的结构简式是_________________________(只要求写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠![]() 在溶液中可生成
在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用,但
都具有漂白作用,但![]() 是有毒气体;经测定,
是有毒气体;经测定,![]() 时各组分含量随pH变化情况如图所示
时各组分含量随pH变化情况如图所示![]() 没有画出
没有画出![]() 则下列分析正确的是( )
则下列分析正确的是( )
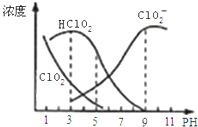
A.亚氯酸钠在酸性条件下较稳定
B.![]() 时,
时,![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
C.pH越大,该漂白剂的漂白性能越好
D.![]() ,
,![]() 时,
时,![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡 H2O![]() H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO3溶液B.向水中加入 NH4Cl 溶液
C.向水中加入CH3COONa 溶液D.将水加热到 100℃,使 pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是![]() 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl |
|
| HClO |
|
|
|
|
|
|
|
A.相同浓度![]() 和
和![]() 的混合液中,各离子浓度的大小关系是
的混合液中,各离子浓度的大小关系是![]()
B.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
C.向![]() HClO溶液中滴加NaOH溶液至
HClO溶液中滴加NaOH溶液至![]() :
:![]() 1:3,此时溶液
1:3,此时溶液![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀
先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有许多用途。回答下列问题:
⑴碳元素有12C、13C和14C等核素。下列对12C基态原子结构的表示方法中,对电子运动状态描述最详尽的是_______(填标号)。
A. B.
B.![]()
C.1s22s22p2 D.
基态13C原子核外有________种不同空间运动状态的电子。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键的类型为________,该化学键能够形成的原因是________。
⑶有机物 是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
⑷乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,两者相对分子质量接近,但乙二胺比三甲胺的沸点高得多,原因是________。
⑸碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是________。
⑹石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为ρgcm-3,C—C键长为γ cm,阿伏加德罗常数的值为NA,则石墨晶体的层间距为________cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:![]()
![]()
![]() 。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
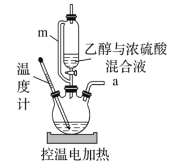
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165~175℃
C.反应混合液的加入顺序依次为乙醇、浓硫酸
D.加热时若发现三颈瓶中未加碎瓷片,应立即补加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com