
【题目】下表是![]() 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl |
|
| HClO |
|
|
|
|
|
|
|
A.相同浓度![]() 和
和![]() 的混合液中,各离子浓度的大小关系是
的混合液中,各离子浓度的大小关系是![]()
B.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
C.向![]() HClO溶液中滴加NaOH溶液至
HClO溶液中滴加NaOH溶液至![]() :
:![]() 1:3,此时溶液
1:3,此时溶液![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀
先形成沉淀
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式为SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ΔH=QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
Si(s)+4HCl(g) ΔH=QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如图所示:已知脱氢是氧化反应
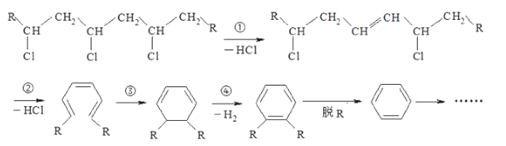
下列说法不正确的是( )
A.聚氯乙烯的单体可由乙烯与HCl加成而得
B.上述反应中①属于消去反应,④属于(脱氢)氧化反应
C.火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D.在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.在![]() 溶液中一定有:
溶液中一定有:![]()
C.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
D.10mL![]()
![]()
![]() 溶液与10mL1
溶液与10mL1![]() 盐酸混合:
盐酸混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为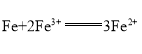 ,下列与此电池总反应不符的原电池是( )
,下列与此电池总反应不符的原电池是( )
A.铜片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
B.石墨、铁片、![]() 溶液组成的原电池
溶液组成的原电池
C.铁片、锌片、![]() 溶液组成的原电池
溶液组成的原电池
D.银片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物的用途非常广泛![]() 回答下列问题:
回答下列问题:
⑴基态锰原子的外围电子排布式为______________________,其d轨道中未成对电子数为__________。
⑵MnO的熔点(1650℃)比MnS的熔点(1610℃)高原因是_____________________________________。
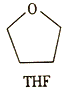
⑶锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
①THF中的元素的电负性从大到小的顺序是__________________。
②与Mn2+形成配位键的原子为______(填元素符号)。
③BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
④写出两种与BH4-互为等电子体的分子或离子___________。
⑷一种磁性材料的单晶胞结构如图所示。
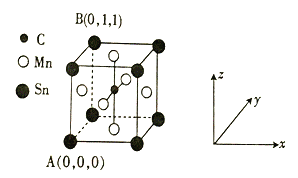
①该晶胞中碳原子的原子坐标为________。
②Mn在晶体中的堆积方式为_______(填“简单立方”“体心立方”或“面心立方最密”)堆积。
③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ = ___________________ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子原理,O3分子的空间构型为________。
(3)氯与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为____________________。

(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=______________________(填数值);氢在合金中的密度为________(保留两位有效数字)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com