
【题目】锰的单质及其化合物的用途非常广泛![]() 回答下列问题:
回答下列问题:
⑴基态锰原子的外围电子排布式为______________________,其d轨道中未成对电子数为__________。
⑵MnO的熔点(1650℃)比MnS的熔点(1610℃)高原因是_____________________________________。
⑶锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
①THF中的元素的电负性从大到小的顺序是__________________。
②与Mn2+形成配位键的原子为______(填元素符号)。
③BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
④写出两种与BH4-互为等电子体的分子或离子___________。
⑷一种磁性材料的单晶胞结构如图所示。
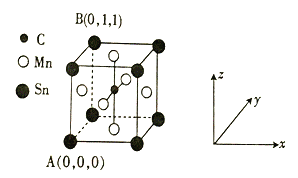
①该晶胞中碳原子的原子坐标为________。
②Mn在晶体中的堆积方式为_______(填“简单立方”“体心立方”或“面心立方最密”)堆积。
③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ = ___________________ gcm-3。
【答案】3d54s2 5 同为离子晶体,MnO和MnS的电荷数一样,r(O2-) < r (S2-),MnO的晶格能大,熔点更高 O > C > H O 正四面体 sp3 CH4、SiH4(或NH4+等其他合理答案) (![]() ,
,![]() ,
,![]() ) 面心立方最密
) 面心立方最密 ![]()
【解析】
⑴基态锰原子的外围电子排布式为:3d54s2。
⑵MnO、MnS同为离子晶体,MnO和MnS的电荷数一样,r(O2-) < r (S2-),MnO的晶格能大。
⑶①非金属性越强,电负性越大;②与Mn2+形成配位键的原子为O原子;③BH4-计算价层电子对数。
④价电子数B-=C=Si=N+,写出等电子体。
⑷①根据晶胞可知,碳原子都位于![]() 处,故其原子坐标为:(
处,故其原子坐标为:(![]() ,
,![]() ,
,![]() );②Mn在晶体中的堆积方式为面心立方最密;③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,晶体密度的表达式。
);②Mn在晶体中的堆积方式为面心立方最密;③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,晶体密度的表达式。
⑴基态锰原子的外围电子排布式为:3d54s2;其d轨道中未成对电子数为5,故答案为:3d54s2;5。
⑵MnO的熔点(1650℃)比MnS的熔点(1610℃)高原因是:同为离子晶体,MnO和MnS的电荷数一样,r(O2-) < r (S2-),MnO的晶格能大,熔点更高;故答案为:同为离子晶体,MnO和MnS的电荷数一样,r(O2-) < r (S2-),MnO的晶格能大,熔点更高。
⑶①非金属性越强,电负性越大,故电负性大小为:O > C > H;故答案为:O > C > H。
②与Mn2+形成配位键的原子为O原子,故答案为:O。
③BH4-价层电子对数4对,空间构型为正四面体,其中B原子的杂化轨道类型为sp3;故答案为:正四面体;sp3。
④价电子数B-=C=Si=N+,因此与BH4-互为等电子体的分子或离子CH4、SiH4(或NH4+等其他合理答案);故答案为:CH4、SiH4(或NH4+等其他合理答案)。
⑷①根据晶胞可知,碳原子都位于![]() 处,故其原子坐标为:(
处,故其原子坐标为:(![]() ,
,![]() ,
,![]() );故答案为:(
);故答案为:(![]() ,
,![]() ,
,![]() )。
)。
②Mn在晶体中的堆积方式为面心立方最密,故答案为:面心立方最密。
③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,晶胞质量为:![]() 则该晶体密度的表达式为
则该晶体密度的表达式为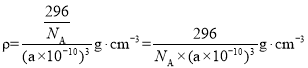 ;故答案为:
;故答案为:![]() 。
。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠![]() 在溶液中可生成
在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用,但
都具有漂白作用,但![]() 是有毒气体;经测定,
是有毒气体;经测定,![]() 时各组分含量随pH变化情况如图所示
时各组分含量随pH变化情况如图所示![]() 没有画出
没有画出![]() 则下列分析正确的是( )
则下列分析正确的是( )
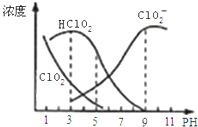
A.亚氯酸钠在酸性条件下较稳定
B.![]() 时,
时,![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
C.pH越大,该漂白剂的漂白性能越好
D.![]() ,
,![]() 时,
时,![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是![]() 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl |
|
| HClO |
|
|
|
|
|
|
|
A.相同浓度![]() 和
和![]() 的混合液中,各离子浓度的大小关系是
的混合液中,各离子浓度的大小关系是![]()
B.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
C.向![]() HClO溶液中滴加NaOH溶液至
HClO溶液中滴加NaOH溶液至![]() :
:![]() 1:3,此时溶液
1:3,此时溶液![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀
先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有许多用途。回答下列问题:
⑴碳元素有12C、13C和14C等核素。下列对12C基态原子结构的表示方法中,对电子运动状态描述最详尽的是_______(填标号)。
A. B.
B.![]()
C.1s22s22p2 D.
基态13C原子核外有________种不同空间运动状态的电子。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键的类型为________,该化学键能够形成的原因是________。
⑶有机物 是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
⑷乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,两者相对分子质量接近,但乙二胺比三甲胺的沸点高得多,原因是________。
⑸碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是________。
⑹石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为ρgcm-3,C—C键长为γ cm,阿伏加德罗常数的值为NA,则石墨晶体的层间距为________cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
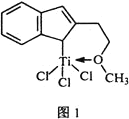
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
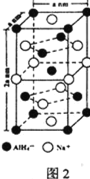
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:![]()
![]()
![]() 。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
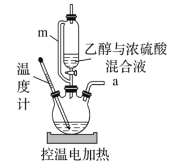
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165~175℃
C.反应混合液的加入顺序依次为乙醇、浓硫酸
D.加热时若发现三颈瓶中未加碎瓷片,应立即补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(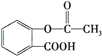 )是常用的解热镇痛药,下列说法不正确的是( )
)是常用的解热镇痛药,下列说法不正确的是( )
A.1mol阿司匹林可以与3molNaOH反应
B.阿司匹林与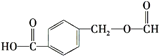 互为同分异构体
互为同分异构体
C.阿司匹林可以发生取代反应、加成反应、酯化反应
D.1mol阿司匹林可以与5molH2发生加成反应,也可与1mol碳酸氢钠反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com