
【题目】碳及其化合物有许多用途。回答下列问题:
⑴碳元素有12C、13C和14C等核素。下列对12C基态原子结构的表示方法中,对电子运动状态描述最详尽的是_______(填标号)。
A. B.
B.![]()
C.1s22s22p2 D.
基态13C原子核外有________种不同空间运动状态的电子。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键的类型为________,该化学键能够形成的原因是________。
⑶有机物 是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
⑷乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,两者相对分子质量接近,但乙二胺比三甲胺的沸点高得多,原因是________。
⑸碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是________。
⑹石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为ρgcm-3,C—C键长为γ cm,阿伏加德罗常数的值为NA,则石墨晶体的层间距为________cm。

【答案】D 6 配位键 Fe3+提供空轨道,CN-提供孤电子对形成配位键 极性 N > O > C 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 碳酸盐在热分解过程中,晶体中的金属阳离子与CO32-中的氧原子接合,使CO32-分解为CO2。当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高 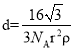
【解析】
⑴碳元素有12C、13C和14C等核素,作为同位素,质子数一样,核外电子排布一样,C原子核外电子排布为1s22s22p2,对电子运动状态描述最详尽的是轨道表达式,基态13C原子核外有6种不同空间运动状态的电子。
⑵ Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-提供孤对电子,所以能形成配位键。
⑶有机物![]() 是极性分子,第一电离能增大趋势,但有特殊。
是极性分子,第一电离能增大趋势,但有特殊。
⑷乙二胺分子间可以形成氢键。
⑸碳酸盐在热分解过程中,当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高。
⑹根据石墨的晶胞结构,先求底面积,求出C原子数目,根据密度等于质量除以体积进行计算。
⑴碳元素有12C、13C和14C等核素,作为同位素,质子数一样,核外电子排布一样,C原子核外电子排布为1s22s22p2,轨道式为如图所示:![]() ,则在基态14C原子中,对电子运动状态描述最详尽的是D,基态13C原子核外有6种不同空间运动状态的电子;故答案为:D;6。
,则在基态14C原子中,对电子运动状态描述最详尽的是D,基态13C原子核外有6种不同空间运动状态的电子;故答案为:D;6。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-提供孤对电子,所以能形成配位键;故答案为:配位键;Fe3+提供空轨道,CN-提供孤电子对形成配位键。
⑶有机物![]() 是极性分子,化合物中O、N、C三种原子的杂化轨道形成均为sp3,其对应元素的第一电离能由大到小的顺序为:N > O > C;故答案为:极性;N > O > C。
是极性分子,化合物中O、N、C三种原子的杂化轨道形成均为sp3,其对应元素的第一电离能由大到小的顺序为:N > O > C;故答案为:极性;N > O > C。
⑷乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
⑸碳酸盐在热分解过程中,晶体中的金属阳离子与CO32-中的氧原子接合,使CO32-分解为CO2。当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高;故答案为:碳酸盐在热分解过程中,晶体中的金属阳离子与CO32-中的氧原子接合,使CO32-分解为CO2。当金属阳离子所带电荷数相同时,阳离子半径越大,其结合CO32-中的氧原子的能力就越弱,对应的碳酸盐就越难分解,所需热分解温度就越高。
⑹根据石墨的晶胞结构,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为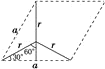 ,则
,则![]() ,可得
,可得![]() ,则底面面积为
,则底面面积为![]() ,晶胞中C原子数目为
,晶胞中C原子数目为![]() ,晶胞质量为
,晶胞质量为![]() ,则
,则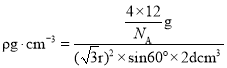 ,整理可得
,整理可得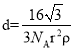 ;故答案为:
;故答案为: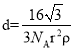 。
。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.在![]() 溶液中一定有:
溶液中一定有:![]()
C.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
D.10mL![]()
![]()
![]() 溶液与10mL1
溶液与10mL1![]() 盐酸混合:
盐酸混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A.将饱和氯水滴到淀粉碘化钾试纸上出现如图所示的现象,说明低浓度氯水能将I-氧化成I2,高浓度氯水能将I2进一步氧化成碘的化合物
B.将过量CO2通入Ca(ClO)2溶液中得到澄清溶液,说明H2CO3的酸性比HClO的弱
C.用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3)
D.铝箔在酒精灯火焰上加热熔化,但不滴落,说明铝箔表面的氧化铝膜的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物的用途非常广泛![]() 回答下列问题:
回答下列问题:
⑴基态锰原子的外围电子排布式为______________________,其d轨道中未成对电子数为__________。
⑵MnO的熔点(1650℃)比MnS的熔点(1610℃)高原因是_____________________________________。
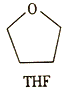
⑶锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
①THF中的元素的电负性从大到小的顺序是__________________。
②与Mn2+形成配位键的原子为______(填元素符号)。
③BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
④写出两种与BH4-互为等电子体的分子或离子___________。
⑷一种磁性材料的单晶胞结构如图所示。
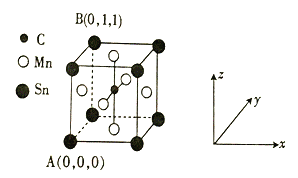
①该晶胞中碳原子的原子坐标为________。
②Mn在晶体中的堆积方式为_______(填“简单立方”“体心立方”或“面心立方最密”)堆积。
③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ = ___________________ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸,溶液含R微粒的物质的量分数与pH关系如图所示
盐酸,溶液含R微粒的物质的量分数与pH关系如图所示![]() 不稳定,易转化为
不稳定,易转化为![]() 气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化
气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化![]() 下列说法错误的是
下列说法错误的是![]()
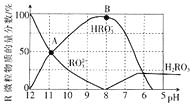
A.![]() 溶液中:
溶液中:![]()
B.当溶液![]() 时,溶液总体积大于40mL
时,溶液总体积大于40mL
C.在B点对应的溶液中,离子浓度最大的是![]()
D.A点对应pH约为![]() ,
,![]() 的水解常数
的水解常数![]() 数量级为
数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油是化工原料的重要来源,从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂。从煤焦油中可获得烃B,B中碳、氢两种元素的质量比为12:1,且B是常见的有机溶剂。工业上可以通过以下途径获得A、B。
![]()
![]()
(1)由煤得到煤焦油的方法称为________;由石蜡油获得A的方法称为________。
(2)A和B中,能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”)。
(3)写出B发生取代反应的化学方程式:________________________(写一个即可,并注明反应条件)。
(4)用B和丙烯可以生产两种重要的化工原料:苯酚(![]() )和丙酮(
)和丙酮(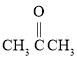 ),生产流程如下:
),生产流程如下:
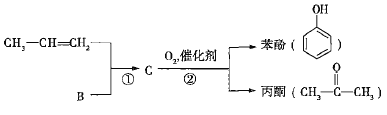
已知反应①是加成反应,C的一氯代物有5种,则C的结构简式为_____________;反应②的化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com