
【题目】室温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸,溶液含R微粒的物质的量分数与pH关系如图所示
盐酸,溶液含R微粒的物质的量分数与pH关系如图所示![]() 不稳定,易转化为
不稳定,易转化为![]() 气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化
气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化![]() 下列说法错误的是
下列说法错误的是![]()
A.![]() 溶液中:
溶液中:![]()
B.当溶液![]() 时,溶液总体积大于40mL
时,溶液总体积大于40mL
C.在B点对应的溶液中,离子浓度最大的是![]()
D.A点对应pH约为![]() ,
,![]() 的水解常数
的水解常数![]() 数量级为
数量级为![]()
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有许多用途。回答下列问题:
⑴碳元素有12C、13C和14C等核素。下列对12C基态原子结构的表示方法中,对电子运动状态描述最详尽的是_______(填标号)。
A. B.
B.![]()
C.1s22s22p2 D.
基态13C原子核外有________种不同空间运动状态的电子。
⑵K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键的类型为________,该化学键能够形成的原因是________。
⑶有机物 是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
是________(填“极性”或“非极性”)分子;该有机物中存在sp3杂化的原子,其对应元素的第一电离能由大到小的顺序为________。
⑷乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)3]均属于胺,两者相对分子质量接近,但乙二胺比三甲胺的沸点高得多,原因是________。
⑸碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是________。
⑹石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为ρgcm-3,C—C键长为γ cm,阿伏加德罗常数的值为NA,则石墨晶体的层间距为________cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
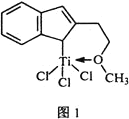
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
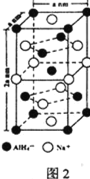
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图,下列叙述不正确的是( )
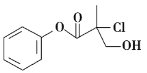
A.有机物A含有3种官能团
B.有机物A和NaOH的醇溶液共热可发生消去反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A能使溴水和酸性高锰酸钾溶液均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:![]()
![]()
![]() 。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
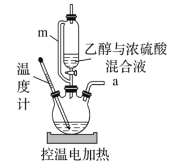
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165~175℃
C.反应混合液的加入顺序依次为乙醇、浓硫酸
D.加热时若发现三颈瓶中未加碎瓷片,应立即补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
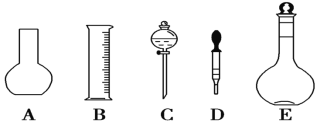
(2)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.3 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.3 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
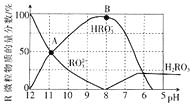
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值![]() 表示
表示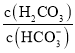 或
或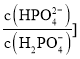 与pH的关系如图所示。已知碳酸
与pH的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]()
![]() 。则下列说法不正确的是( )
。则下列说法不正确的是( )
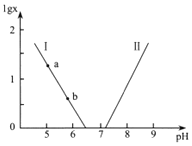
A.曲线Ⅱ表示 与pH的变化关系
与pH的变化关系
B.![]() 的过程中,水的电离程度逐渐增大
的过程中,水的电离程度逐渐增大
C.当![]()
![]() 时,
时,![]()
D.当pH增大时,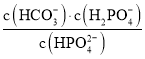 逐渐增大
逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com