
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】4mol A和4mol B两种气体在2L的密闭容器中发生反应,生成C和D两种气体。方程式为:2A+B=2C+D。前15s内,A的平均反应速率为0.12mol/(L·s),则15s时,容器中B的物质的量为
A. 3.2mol B. 2.2mol C. 1.8mol D. 2.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量分数为90%的硫酸溶液和质量分数为10%的硫酸溶液等体积混合后溶质的质量分数
A. 大于50%
B. 等于50%
C. 小于50%
D. 不能做上述估计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的______________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含______(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O Ba2++CrO42﹣═BaCrO4↓
步骤Ⅰ:移取x ml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0 mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的______________(填“上方”或“下方”)。BaCl2溶液的浓度为______________ molL-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,在固定容积的密闭容器中,不能表示反应X(气)+2Y(气)![]() 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
A. 容器内压强不随时间改变B. 容器内混合气体的密度不随时间改变
C. 生成Z的速率与生成Y的速率相等D. 混合气体的平均相对分子质量不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,若该分子中仅含有3个甲基(—CH3),则其一氯取代物最多有( )种(不考虑立体异构)
A. 7 B. 8 C. 9 D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图。
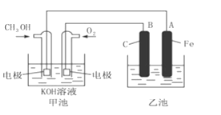
下列说法中不正确的是
A. 甲池的总反应式为:2CH3OH+3O2+4KOH== 2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为4OH--4e- = 2H2O+O2↑
C. 若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
D. 常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为CH3OH(l)+1.5O2(g) ==CO2(g)+2H2O(l) ΔH= -725.80 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。
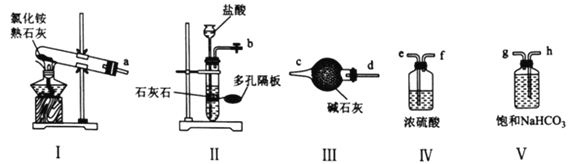
①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:
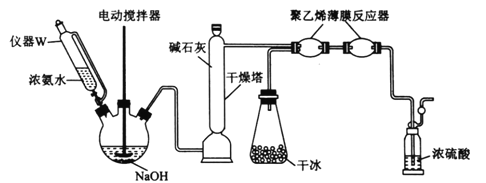
①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com