
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:![]()
![]()
![]() 。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
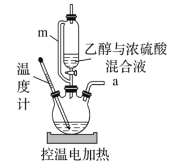
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165~175℃
C.反应混合液的加入顺序依次为乙醇、浓硫酸
D.加热时若发现三颈瓶中未加碎瓷片,应立即补加
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.![]()
![]()
![]() 的
的![]() 溶液中:
溶液中:![]()
B.在![]() 溶液中一定有:
溶液中一定有:![]()
C.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
D.10mL![]()
![]()
![]() 溶液与10mL1
溶液与10mL1![]() 盐酸混合:
盐酸混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物的用途非常广泛![]() 回答下列问题:
回答下列问题:
⑴基态锰原子的外围电子排布式为______________________,其d轨道中未成对电子数为__________。
⑵MnO的熔点(1650℃)比MnS的熔点(1610℃)高原因是_____________________________________。
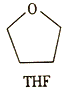
⑶锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
①THF中的元素的电负性从大到小的顺序是__________________。
②与Mn2+形成配位键的原子为______(填元素符号)。
③BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
④写出两种与BH4-互为等电子体的分子或离子___________。
⑷一种磁性材料的单晶胞结构如图所示。
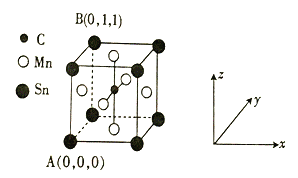
①该晶胞中碳原子的原子坐标为________。
②Mn在晶体中的堆积方式为_______(填“简单立方”“体心立方”或“面心立方最密”)堆积。
③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ = ___________________ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸,溶液含R微粒的物质的量分数与pH关系如图所示
盐酸,溶液含R微粒的物质的量分数与pH关系如图所示![]() 不稳定,易转化为
不稳定,易转化为![]() 气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化
气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化![]() 下列说法错误的是
下列说法错误的是![]()
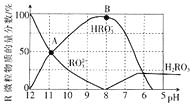
A.![]() 溶液中:
溶液中:![]()
B.当溶液![]() 时,溶液总体积大于40mL
时,溶液总体积大于40mL
C.在B点对应的溶液中,离子浓度最大的是![]()
D.A点对应pH约为![]() ,
,![]() 的水解常数
的水解常数![]() 数量级为
数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)_______0.2 mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_____mol/L;
c(H+)-c(MOH)=__________mol/L
⑵常温下若将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度______NaA的水解程度。(填“>”、“<”、或“=”)
⑶已知:难溶电解质Cu(OH)2在常温下的Ksp = 2×1020,则常温下:某CuSO4溶液中c(Cu2+) = 0.02 mol·L1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为_________。
⑷已知:温度和浓度相等时,氨水的电离程度与醋酸相等。常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列___________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
化学式 |
|
| HClO |
电离平衡常数 |
|
|
|
回答下列问题:
(1)一般情况下,当温度升高时,![]() ______填“增大”、“减小”或“不变”。
______填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是______填序号;
a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是______填序号
a. ![]()
b. ![]()
c. ![]()
d. ![]()
(4)用蒸馏水稀释![]() 的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
a. 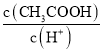 b.
b. ![]() c.
c.![]() d.
d.![]()
(5)体积均为10mLpH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
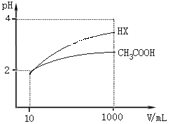
则HX的电离平衡常数______填“大于”、“等于”或“小于”,下同醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的c(H+),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子原理,O3分子的空间构型为________。
(3)氯与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为____________________。

(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=______________________(填数值);氢在合金中的密度为________(保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油是化工原料的重要来源,从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂。从煤焦油中可获得烃B,B中碳、氢两种元素的质量比为12:1,且B是常见的有机溶剂。工业上可以通过以下途径获得A、B。
![]()
![]()
(1)由煤得到煤焦油的方法称为________;由石蜡油获得A的方法称为________。
(2)A和B中,能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”)。
(3)写出B发生取代反应的化学方程式:________________________(写一个即可,并注明反应条件)。
(4)用B和丙烯可以生产两种重要的化工原料:苯酚(![]() )和丙酮(
)和丙酮(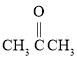 ),生产流程如下:
),生产流程如下:
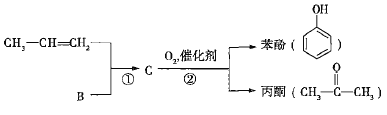
已知反应①是加成反应,C的一氯代物有5种,则C的结构简式为_____________;反应②的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在适宜的条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca(OH)2+2H2↑
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com