
【题目】⑴常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)_______0.2 mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_____mol/L;
c(H+)-c(MOH)=__________mol/L
⑵常温下若将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度______NaA的水解程度。(填“>”、“<”、或“=”)
⑶已知:难溶电解质Cu(OH)2在常温下的Ksp = 2×1020,则常温下:某CuSO4溶液中c(Cu2+) = 0.02 mol·L1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为_________。
⑷已知:温度和浓度相等时,氨水的电离程度与醋酸相等。常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列___________(填序号)
【答案】> 9.9×107 1.0×108 > 5 ④①③②
【解析】
⑴①混合溶液MCl溶质,水解显酸性,促进水的电离,而盐酸是抑制水的电离;②测得混合溶液的pH=6,根据电荷守恒,c(Cl-)+c(OH-)= c(H+)+c(M+),质子守恒c(H+) =c(MOH) + c(OH-)分析并计算。
⑵分析反应后溶质,根据混合溶液的pH<7分析电离程度和水解程度大小。
⑶根据溶度积常数进行计算。
⑷分析溶液的酸碱性,再根据混合溶液与单一溶液的关系分析。
⑴常温下将0.2 molL1 HCl溶液与0.2 molL1 MOH溶液等体积混合(忽略混合后溶液体积的变化),溶质是MCl,测得混合溶液的pH=6,说明溶液显酸性,水解显酸性。
①混合溶液MCl溶质,水解显酸性,促进水的电离,而盐酸是抑制水的电离,因此由水电离出的c(H+)>0.2 molL1的HCl溶液中由水电离出的c(H+);故答案为:>。
②测得混合溶液的pH=6,根据电荷守恒,c(Cl-)+c(OH-)= c(H+)+c(M+),c(Cl-)-c(M+)= c(H+)-c(OH-) = 1.0×106 molL1-1.0×108 molL1 =9.9×107 molL1;根据质子守恒c(H+) =c(MOH) + c(OH-),得到c(H+)-c(MOH)= c(OH-)=1.0×108 molL1;故答案为:9.9×107;1.0×108。
⑵常温下若将0.2 molL1 HA溶液与0.1 molL1 NaOH溶液等体积混合,溶质为NaA和HA且浓度相等,测得混合溶液的pH<7,溶液显酸性,则说明在相同条件下HA的电离程度>NaA的水解程度;故答案为:>。
⑶如要生成Cu(OH)2沉淀,根据![]() ,得到
,得到![]() ,
,![]() ,pH = 5,因此应调整溶液的pH最小为5;故答案为:5。
,pH = 5,因此应调整溶液的pH最小为5;故答案为:5。
⑷①0.1 molL1 CH3COONa,溶液显碱性;②0.1 molL1 CH3COONH4,溶液呈中性;③0.1 molL1 CH3COOH,溶液呈酸性;④0.1 molL1 CH3COONa和0.1 molL1 NaOH的混合溶液,溶液显碱性,相当于在①基础上加NaOH溶液,因此碱性比①碱性更强,pH更大,因此按pH由大到小顺序排列④①③②;故答案为:④①③②。


科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
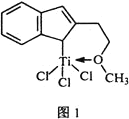
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
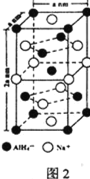
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:![]()
![]()
![]() 。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
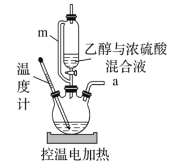
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165~175℃
C.反应混合液的加入顺序依次为乙醇、浓硫酸
D.加热时若发现三颈瓶中未加碎瓷片,应立即补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
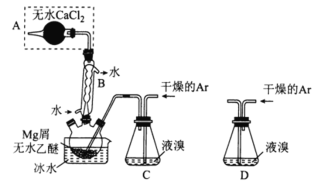
主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
⑴仪器A的名称是___________。B的作用为___________。
⑵下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
⑶若将装置C改为装置D,可能会导致的后果是___________。
⑷为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是_______________(用质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知氨气的化学式是NH3,其摩尔质量为____;6.8g NH3的物质的量为___mol,其标准状况下的体积为___L,其含NH3分子的个数为___,含有氢原子的个数为_____。
(2)在①、②、③、④处的横线上填上适当的内容。______、__________、______、__________
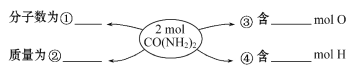
(3)12.4 g Na2R含0.4 mol Na+,则Na2R的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有关反应的能量变化如图,试回答下列问题。
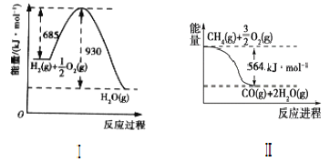
(1)根据图像,写出Ⅰ的热化学方程式:____。
(2)写出CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:____。
(3)在(2)的反应中,相关的化学键键能数据如下表所示。判断H2O(g)中O—H的键能为___。
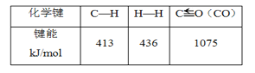
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①C(s)+CO2(g)=2CO(g)△H1,C(s)+![]() O2(g)=CO(g)△H2则△H1___△H2。
O2(g)=CO(g)△H2则△H1___△H2。
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H3,CH4(g)+H2O(l)=CO(g)+3H2(g)△H4,则△H3___△H4
③2H2(g)+O2(g)=2H2O(1)△H4,2H2(g)+O2(g)=2H2O(g)△H5,则△H4___△H5。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com