
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

【答案】1s22s22p3 ⅥB K<Cr CrCl3是分子晶体,CrF3是离子晶体 正四面体 6 配位 sp3 N>C>H ![]()
【解析】
(1)N元素是7号元素,根据核外电子排布规律,得出基态N原子的核外电子排布,Cr是24号元素,在周期表第四周期ⅥB族;
(2)K最外层电子一个,易失去,Cr元素的价电子为3d54s1,半充满,较稳定,故第一电离能K<Cr;CrCl3的熔点(83℃),典型的分子晶体性质,CrF3的熔点(1100℃),典型的离子晶体性质;
(3)①算出阴离子C1O4-的价层电子对数,得出其空间构型;
②由图可知,与中心Cr形成的配位数为6;N元素提供孤电子对,Cr提供空轨道,所以N与中心原子形成的化学键称为配位键;
③由H2NCH2CH2NH2可知,C周围形成了4个单键,即价层电子对数为4,碳原子的杂化方式为sp3;根据电负性在周期表中的变化规律,C、N、H的电负性关系;
(4)由晶胞图,根据均摊法,晶胞中Cr与N的原子数目再根据晶胞的密度=晶胞的质量与晶胞的体积之比作答。
(1)N元素是7号元素,故基态N原子的核外电子排布式为1s22s22p3,Cr是24号元素,在周期表第四周期ⅥB族;
故答案为:1s22s22p3,ⅥB;
(2)K最外层电子一个,易失去,Cr元素的价电子为3d54s1,半充满,较稳定,故第一电离能K<Cr;CrCl3的熔点(83℃),典型的分子晶体性质,CrF3的熔点(1100℃),典型的离子晶体性质;
故答案为:K<Cr;CrCl3是分子晶体,CrF3是离子晶体;
(3)①阴离子C1O4-的价层电子对数=4+![]() =4,没有孤电子对,所以其空间构型为正四面体;
=4,没有孤电子对,所以其空间构型为正四面体;
故答案为:正四面体;
②由图可知,与中心Cr形成的配位数为6;N元素提供孤电子对,Cr提供空轨道,所以N与中心原子形成的化学键称为配位键;
故答案为:6;配位键;
③由H2NCH2CH2NH2可知,C周围形成了4个单键,即价层电子对数为4,碳原子的杂化方式为sp3;根据电负性在周期表中的变化规律,C、N、H的电负性关系为:N>C>H;
故答案为:sp3;N>C>H;
(4)由晶胞图,根据均摊法,晶胞中Cr的原子数目:![]() = 4;N的原子数目:
= 4;N的原子数目:![]() =4;所以晶胞的质量m=
=4;所以晶胞的质量m=![]() ,密度ρ=
,密度ρ=![]() ,所以a=
,所以a=![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+) < c(Cl-)
B.向 NH4Cl 溶液中通 NH3,则 c(![]() ) >c(Cl-) > c(OH-)> c(H+)
) >c(Cl-) > c(OH-)> c(H+)
C.室温下,c(![]() )相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
)相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
D.已知 pKa= -lgKa,pKa(HF)=3.1,pKa(C6H5COOH) = 4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)已知:丁二酮肟[HON=(CH3)CC(CH3)=NOH]是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为___,1mol丁二酮肟分子所含σ键的数目为___。
(2)单质铜及镍都是金属晶体;铜晶体的堆积方式为___;元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图(1)。写出该反应的化学方程式:___。

(4)下列关于铁和镍及其化合物说法正确的是___
a.金属镍能与CO形成配合物Ni(CO)4,常温下为液态,易溶于CCl4、苯等有机溶剂。所以Ni(CO)4固态时属于分子晶体
b.[Ni(NH3)6]SO4中阴离子的立体构型是正八面体
c.Ni2+和Fe2+的半径分别为69pm和78pm,则晶格能NiO>FeO,熔点NiO>FeO
d.铁晶胞结构见图(2),每个晶胞含有2个铁原子
(5)配合物Y的结构见图(3),Y中含有的化学键有___![]() 填序号
填序号![]() ;
;
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.离子键 f.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有铜和氧化铁的混合物ag,当慢慢滴入![]() 的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
A.等于![]()
![]() B.大于
B.大于![]()
![]()
C.大于![]() D.等于
D.等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)_______0.2 mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_____mol/L;
c(H+)-c(MOH)=__________mol/L
⑵常温下若将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度______NaA的水解程度。(填“>”、“<”、或“=”)
⑶已知:难溶电解质Cu(OH)2在常温下的Ksp = 2×1020,则常温下:某CuSO4溶液中c(Cu2+) = 0.02 mol·L1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为_________。
⑷已知:温度和浓度相等时,氨水的电离程度与醋酸相等。常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列___________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
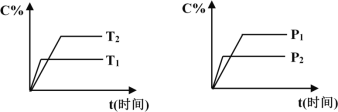
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列说法正确的是( )
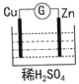
A.正极发生氧化反应
B.SO![]() 向负极移动
向负极移动
C.电子是由Zn片通过溶液流向Cu片
D.正极的电极反应式为Zn-2e-=Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com