
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
【答案】Ni(OH)2(s)+OH-(aq) e- =NiOOH(s)+H2O(l) Zn(s)+2OH-(aq) 2e-=ZnO(s)+H2O(l) 从正极区移向负极区
【解析】
电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s),分析得到Zn失去电子,化合价升高,NiOOH中Ni化合价降低,得到电子。
ZnO(s)+2Ni(OH)2(s),分析得到Zn失去电子,化合价升高,NiOOH中Ni化合价降低,得到电子。
⑴放电时正极为NiOOH(s) + H2O(l) + e-= Ni(OH)2(s)+OH-(aq),充电时阳极反应为Ni(OH)2(s)+OH-(aq) e- =NiOOH(s)+H2O(l);故答案为:Ni(OH)2(s)+OH-(aq) e- =NiOOH(s)+H2O(l)。
⑵放电时负极是锌失去电子,和OH-反应生成ZnO和H2O,其反应为Zn(s)+2OH-(aq) 2e-=ZnO(s)+H2O(l);故答案为:Zn(s)+2OH-(aq) 2e-=ZnO(s)+H2O(l)。
⑶放电过程中根据“异性相吸”,因此OH-通过隔膜从区移向从正极区移向负极区;故答案为:从正极区移向负极区。


科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时N2O5的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
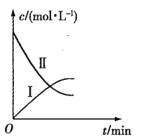
A.曲线I是N2O5的浓度变化曲线
B.曲线Ⅱ是N2O5的浓度变化曲线
C.N2O5的浓度越大,反应速率越快
D.O2的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年化学科学家用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72-)的示意图如图所示,反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。已知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O。下列说法错误的是( )

A.装置①中,a极的电极反应为HS--8e-+4H2O=SO42-+9H+
B.向装置②中加入适量Na2SO4,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6mol H+通过质子交换膜时,装置②中产生0.4mol沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
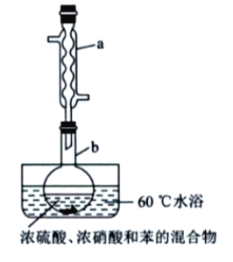
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物丰富多彩,且都有一定的用途。
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,S2Cl2的电子式为________。S2Cl2遇水很容易发生水解反应生成一种淡黄色固体和两种气体,其反应的化学方程式为__________________________________。
(2)用作氧化剂的过二硫酸铵[(NH4)2S2O8]属于离子化合物,易溶于水,其可由硫酸铵[(NH4)2SO4]为原料制备。
①(NH4)2SO4溶液呈酸性的原因是________________________(用离子方程式表示),(NH4)2SO4溶液中各种离子的浓度由大到小的顺序为________________________。
②若硫酸铵溶液的浓度为250 g·L-1,其物质的量浓度是________mol·L-1。
③(NH4)2S2O8在Ag+的催化作用下能将Mn2+氧化成MnO![]() ,其反应的离子方程式为__________________________________________________________________。
,其反应的离子方程式为__________________________________________________________________。
(3)Na2S2O4在空气分析中常用来吸收氧气,当吸收氧气、水蒸气后发生反应时,若还原剂和氧化剂的物质的量之比为1∶1,则产物为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
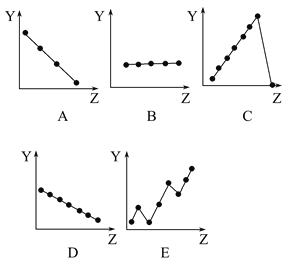
把与元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素原子的价电子数___________;
(2)第三周期元素的最高正化合价___________;
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___________;
(4)第二周期元素的原子半径(不包括稀有气体) ___________;
(5)第二周期元素的第一电离能 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO![]()
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO![]() 、SO
、SO![]()
C.含有Ca2+的溶液中:Na+、K+、CO![]() 、Cl-
、Cl-
D.水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com