
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)已知:丁二酮肟[HON=(CH3)CC(CH3)=NOH]是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为___,1mol丁二酮肟分子所含σ键的数目为___。
(2)单质铜及镍都是金属晶体;铜晶体的堆积方式为___;元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图(1)。写出该反应的化学方程式:___。

(4)下列关于铁和镍及其化合物说法正确的是___
a.金属镍能与CO形成配合物Ni(CO)4,常温下为液态,易溶于CCl4、苯等有机溶剂。所以Ni(CO)4固态时属于分子晶体
b.[Ni(NH3)6]SO4中阴离子的立体构型是正八面体
c.Ni2+和Fe2+的半径分别为69pm和78pm,则晶格能NiO>FeO,熔点NiO>FeO
d.铁晶胞结构见图(2),每个晶胞含有2个铁原子
(5)配合物Y的结构见图(3),Y中含有的化学键有___![]() 填序号
填序号![]() ;
;
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.离子键 f.金属键
【答案】sp3和sp2 15NA或(9.03×1024) 面心立方堆积 铜失去的是全充满的3d10电子,镍失去的是4s1电子 8Fe+2NH3![]() 2Fe4N+3H2 acd abcd
2Fe4N+3H2 acd abcd
【解析】
![]() 丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为
丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为![]() 杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为
杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为![]() 杂化,丁二酮肟的结构式为
杂化,丁二酮肟的结构式为 ,分子中含有13个单键,和2个双键,则共含有15个
,分子中含有13个单键,和2个双键,则共含有15个![]() 键,所以1mol丁二酮肟含有
键,所以1mol丁二酮肟含有![]() 键数目为
键数目为![]() 或
或![]()
故答案为:![]() 和
和![]() ;
;![]() 或
或![]() ;
;
![]() 由Cu晶体的晶胞图
由Cu晶体的晶胞图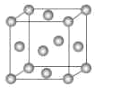 可知,铜晶体的堆积方式为面心立方最密堆积,单质铜及镍都是金属晶体,都是由金属键形成的晶体,
可知,铜晶体的堆积方式为面心立方最密堆积,单质铜及镍都是金属晶体,都是由金属键形成的晶体,
元素铜与镍的第二电离能分别为![]()
![]() 、
、![]()
![]() ,
,![]() ,考虑到铜失去的是全充满的
,考虑到铜失去的是全充满的![]() 电子,镍失去的是
电子,镍失去的是![]() 电子,后者失去较前者容易,
电子,后者失去较前者容易,
故答案为:面心立方堆积;铜失去的是全充满的![]() 电子,镍失去的是
电子,镍失去的是![]() 电子;
电子;
![]() 该晶胞中铁原子个数
该晶胞中铁原子个数![]() ,氮原子个数是1,所以氮化铁的化学式是
,氮原子个数是1,所以氮化铁的化学式是![]() ,铁和氨气在
,铁和氨气在![]() 可发生置换反应生成氢气和氮化铁,所以该反应方程式为:
可发生置换反应生成氢气和氮化铁,所以该反应方程式为: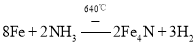 ,
,
故答案为: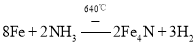 ;
;
![]() 因为
因为![]() 常温下为液态,易溶于
常温下为液态,易溶于![]() 、苯等有机溶剂,根据相似相溶原理知,固态
、苯等有机溶剂,根据相似相溶原理知,固态![]() 属于分子晶体,故a正确;
属于分子晶体,故a正确;
![]() 中阴离子
中阴离子![]() 中S原子的孤电子对数
中S原子的孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,离子空间构型为正四面体,故b错误;
,离子空间构型为正四面体,故b错误;
![]() 影响离子晶体熔点的因素是晶格能,晶格能与离子半径成反比、与电荷数成正比,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,故c正确;
影响离子晶体熔点的因素是晶格能,晶格能与离子半径成反比、与电荷数成正比,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,故c正确;
![]() 铁晶胞中铁占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:
铁晶胞中铁占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:![]() ,故d正确;
,故d正确;
故答案为:acd;
![]() 根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选abcd,
根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选abcd,
故答案为:abcd。


科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
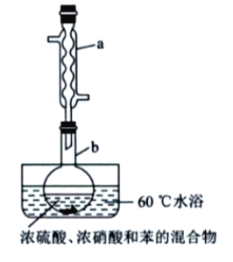
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO![]()
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO![]() 、SO
、SO![]()
C.含有Ca2+的溶液中:Na+、K+、CO![]() 、Cl-
、Cl-
D.水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
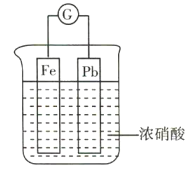
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
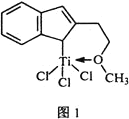
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
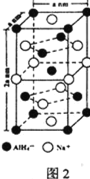
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
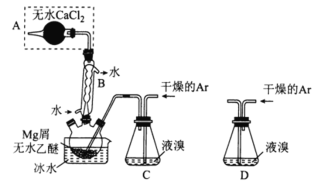
主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
⑴仪器A的名称是___________。B的作用为___________。
⑵下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
⑶若将装置C改为装置D,可能会导致的后果是___________。
⑷为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是_______________(用质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的反应X+3Y![]() 2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
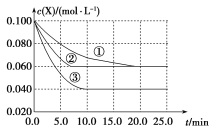
A.反应0~5.0min实验③的反应速率最快B.条件②的反应最先达到平衡
C.②与①比较,②可能压强更大D.该反应的正反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com