
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为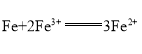 ,下列与此电池总反应不符的原电池是( )
,下列与此电池总反应不符的原电池是( )
A.铜片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
B.石墨、铁片、![]() 溶液组成的原电池
溶液组成的原电池
C.铁片、锌片、![]() 溶液组成的原电池
溶液组成的原电池
D.银片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+) < c(Cl-)
B.向 NH4Cl 溶液中通 NH3,则 c(![]() ) >c(Cl-) > c(OH-)> c(H+)
) >c(Cl-) > c(OH-)> c(H+)
C.室温下,c(![]() )相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
)相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
D.已知 pKa= -lgKa,pKa(HF)=3.1,pKa(C6H5COOH) = 4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物的用途非常广泛![]() 回答下列问题:
回答下列问题:
⑴基态锰原子的外围电子排布式为______________________,其d轨道中未成对电子数为__________。
⑵MnO的熔点(1650℃)比MnS的熔点(1610℃)高原因是_____________________________________。
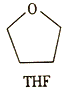
⑶锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
①THF中的元素的电负性从大到小的顺序是__________________。
②与Mn2+形成配位键的原子为______(填元素符号)。
③BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
④写出两种与BH4-互为等电子体的分子或离子___________。
⑷一种磁性材料的单晶胞结构如图所示。
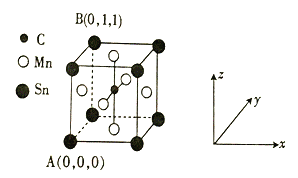
①该晶胞中碳原子的原子坐标为________。
②Mn在晶体中的堆积方式为_______(填“简单立方”“体心立方”或“面心立方最密”)堆积。
③若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ = ___________________ gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)已知:丁二酮肟[HON=(CH3)CC(CH3)=NOH]是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为___,1mol丁二酮肟分子所含σ键的数目为___。
(2)单质铜及镍都是金属晶体;铜晶体的堆积方式为___;元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图(1)。写出该反应的化学方程式:___。

(4)下列关于铁和镍及其化合物说法正确的是___
a.金属镍能与CO形成配合物Ni(CO)4,常温下为液态,易溶于CCl4、苯等有机溶剂。所以Ni(CO)4固态时属于分子晶体
b.[Ni(NH3)6]SO4中阴离子的立体构型是正八面体
c.Ni2+和Fe2+的半径分别为69pm和78pm,则晶格能NiO>FeO,熔点NiO>FeO
d.铁晶胞结构见图(2),每个晶胞含有2个铁原子
(5)配合物Y的结构见图(3),Y中含有的化学键有___![]() 填序号
填序号![]() ;
;
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.离子键 f.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)_______0.2 mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_____mol/L;
c(H+)-c(MOH)=__________mol/L
⑵常温下若将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度______NaA的水解程度。(填“>”、“<”、或“=”)
⑶已知:难溶电解质Cu(OH)2在常温下的Ksp = 2×1020,则常温下:某CuSO4溶液中c(Cu2+) = 0.02 mol·L1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为_________。
⑷已知:温度和浓度相等时,氨水的电离程度与醋酸相等。常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列___________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气体有机物A是一种重要的化工原料,其在标准状况下的密度为![]() 。已知乙烯与乙酸在一定条件下能发生反应生成乙酸乙酯。
。已知乙烯与乙酸在一定条件下能发生反应生成乙酸乙酯。
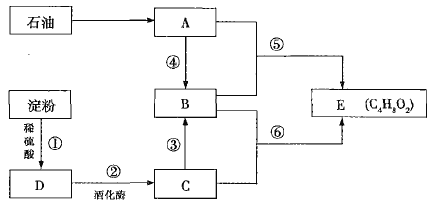
(1)C中的官能团名称是________;⑥的反应类型是________。
(2)反应⑤的化学反应方程式为___________________________________________(反应条件忽略)。
(3)下列说法正确的是________(填序号)。
A.淀粉发生反应①后直接加入银氨溶液可以检验D的生成
B.B、C、E可以用饱和碳酸钠溶液鉴别
C.反应⑥中浓硫酸的作用是催化剂和吸水剂
D.①和④的反应类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com