
����Ŀ����֪�����л���A��һ����Ҫ�Ļ���ԭ�ϣ����ڱ�״���µ��ܶ�Ϊ![]() ����֪��ϩ��������һ���������ܷ�����Ӧ��������������
����֪��ϩ��������һ���������ܷ�����Ӧ��������������
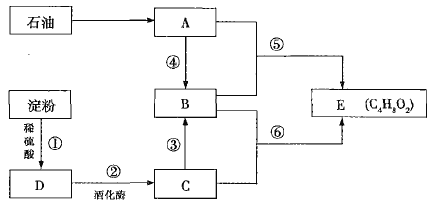
(1)C�еĹ�����������________���ķ�Ӧ������________��
(2)��Ӧ�ݵĻ�ѧ��Ӧ����ʽΪ___________________________________________����Ӧ�������ԣ���
(3)����˵����ȷ����________������ţ���
A.���۷�����Ӧ�ٺ�ֱ�Ӽ���������Һ���Լ���D������
B.B��C��E�����ñ���̼������Һ����
C.��Ӧ����Ũ����������Ǵ�������ˮ��
D.�ٺܵ͢ķ�Ӧ������ͬ
���𰸡��ǻ� ȡ����Ӧ����������Ӧ�� CH2=CH2 + CH3COOH �� CH3COOCH2CH3 BC
��������
ʯ�������Ļ�����һ���������ܵõ������л���A��A�ڱ�״���µ��ܶ�Ϊ1.25gL1��Ħ������M=22.4 L��mol1��1.25gL1=28 gmol1����Է�������Ϊ28��������ϩ����AΪ��ϩ������ˮ������ղ����������ǣ�DΪ�����ǣ��������ھƻ�ø�������������Ҵ���CΪ�Ҵ����Ҵ�������������Ӧ�������ᣬBΪ���ᣬ�������Ҵ�����������Ӧ��������������EΪ����������
(1)��������������֪��CΪ�Ҵ������������ŵ�����Ϊ�ǻ�����Ӧ��Ϊ������Ӧ��������ӦҲ����ȡ����Ӧ���ʴ�Ϊ���ǻ���ȡ����Ӧ(��������Ӧ)��
(2)��������������֪��AΪ��ϩ��BΪ���ᣬ��ϩ�����ᷴӦ����������������Ӧ�ݵĻ�ѧ��Ӧ����ʽΪCH2=CH2 + CH3COOH �� CH3COOCH2CH3���ʴ�Ϊ��CH2=CH2 + CH3COOH �� CH3COOCH2CH3��
(3)A. ���۵�ˮ�ⷴӦ��ϡ����Ĵ������½��У���������Ӧ��Ҫ�ڼ��������½��У�����۷�����Ӧ��ֱ�Ӽ���������Һ�����������ǵ����ɣ���A����B. �Ҵ��뱥��̼������Һ���ܣ�������̼������Һ��Ӧ���������壬����������̼������Һ�����ܶ��ֲ㣬���������ͬ�����Լ��𣬹�B��ȷ��C. ��Ӧ����������Ӧ��Ũ����������Ǵ�������ˮ������C��ȷ��D. �������������ǵķ�Ӧ��ˮ�ⷴӦ����ϩ��������ķ�Ӧ��������Ӧ����Ӧ���Ͳ�ͬ����D����������������ΪBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�������ȷ���� ( )
A.�κ���ʹ��ֵ����Ĺ��̶����Է�����
B.��֪�Ȼ�ѧ����ʽ2SO2(g)��O2(g)![]() 2SO3(g)��H����Q kJ��mol��1(Q��0)����2 mol SO2(g)��1 mol O2(g)����һ�ܱ������г�ַ�Ӧ��ų�Q kJ������
2SO3(g)��H����Q kJ��mol��1(Q��0)����2 mol SO2(g)��1 mol O2(g)����һ�ܱ������г�ַ�Ӧ��ų�Q kJ������
C.��ѧƽ�ⷢ���ƶ���ƽ�ⳣ��һ�������仯
D.1 mol NaOH�ֱ��1 mol CH3COOH��1 mol HNO3��Ӧ�����߱�ǰ�߷ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ����ͼ��ʾ(�г�װ��ʡ��)��
��֪����Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ��
��MgBr2+3C2H5OC2H5![]() MgBr2��3C2H5OC2H5��
MgBr2��3C2H5OC2H5��
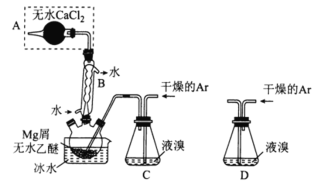
��Ҫ�������£�
����1��������ƿ��װ��10gþм��150mL��ˮ���ѣ�װ��C�м���15mLҺ�壻
����2������ͨ�����������ֱ������ȫ����������ƿ�У�
����3����Ӧ��Ϻ�ָ������£����˳�ȥþ����Һת������һ�������ƿ�У���ȴ��0�����������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4����������CCl4�ܽ��Ʒ����ȴ��0�������羧�壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160���ֽ����ˮMgBr2��Ʒ��
��ش���������
������A��������___________��B������Ϊ___________��
�������йز���4��˵����ȷ����___________(��ѡ����ĸ)
A.����75%���Ҵ�����CCl4�ܽ��Ʒ
B.������160������ҪĿ���dz�ȥCCl4
C.ϴ�Ӿ����ѡ��0����CCl4
D.�ò���ֻ��ȥ�˿��ܲ�������
������װ��C��Ϊװ��D�����ܻᵼ�µĺ����___________��
��Ϊ�ⶨ��Ʒ�Ĵ��ȣ�����EDTA(��дΪY4��)����Һ�ζ����Ը���T(��дΪIn)Ϊָʾ������֪Mg2+�����T��EDTA�����γ�������EDTA��Mg2+��ϸ��ȶ���
���� | ��ɫ | ���� | ��ɫ |
Y4- | ��ɫ | MgY2- | ��ɫ |
In | ����ɫ | MgIn�� | �ƺ�ɫ |
��Ӧ�����ӷ���ʽΪMg2++Y4��=MgY2��
���ζ��յ������Ϊ______________________��
���ⶨǰ���ȳ�ȡ0.2500g��ˮMgBr2��Ʒ���ܽ����2�θ���T��Һ��ָʾ������0.0500mol��L��1��EDTA����Һ�ζ����յ㣬����EDTA����Һ26.50mL��������ˮMgBr2��Ʒ�Ĵ�����_______________(������������ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪�����Ļ�ѧʽ��NH3����Ħ������Ϊ____��6.8g NH3�����ʵ���Ϊ___mol�����״���µ����Ϊ___L���京NH3���ӵĸ���Ϊ___��������ԭ�ӵĸ���Ϊ_____��
��2���ڢ١��ڡ��ۡ��ܴ��ĺ����������ʵ������ݡ�______��__________��______��__________
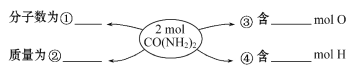
��3��12.4 g Na2R��0.4 mol Na+����Na2R��Ħ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȣ�SO2Cl2����һ���л��Ȼ�����Ҳ��﮵�������������ʡ���֪��������һ����ɫҺ�壬�۵�-54.1�棬�е�69.1�棬��ˮ��������ˮ�⡣
��1����֪��SO2(g) +Cl2(g)+ SCl2(g)![]() 2SOCl2(g) ��H=a kJ��mol-1
2SOCl2(g) ��H=a kJ��mol-1
SO2Cl2(g)+ SCl2(g)![]() 2SOCl2(g) ��H=b kJ��mol-1
2SOCl2(g) ��H=b kJ��mol-1
��Ӧ��SO2(g) + Cl2(g)![]() SO2Cl2(g) ��H =______kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ�����÷�Ӧƽ�ⳣ������ʽΪK =______��
SO2Cl2(g) ��H =______kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ�����÷�Ӧƽ�ⳣ������ʽΪK =______��
��2�������ȿ����������ӦΪ��P4+ 10SO2Cl2= 4PCl5+ 10SO2����������1molSO2����ת�Ƶ��ӵ����ʵ���Ϊ_____mol��
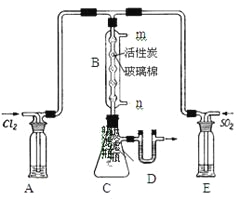
��3��ijѧϰС���ͬѧ���ݷ�Ӧ��SO2(g)+ Cl2(g)![]() SO2Cl2(g) ��H ��0����Ƶ��Ʊ�������װ����ͼ��
SO2Cl2(g) ��H ��0����Ƶ��Ʊ�������װ����ͼ��
![]()
![]()
������Ũ�������������Ϊԭ����ȡCl2���䷴Ӧ�Ļ�ѧ����ʽΪ_____��
����ͼ��ʾ��װ��˵����ȷ����_____��������ѡ��
a.A��E��ϴ��ƿ��ʢ�ŵĿ��ֱܷ��DZ���ʳ��ˮ�ͱ���Na2SO3��Һ
b.B����Ӧ���������в������ϵĻ���̿������
c.B����Ӧ����ȴˮӦ��m�ӿ�ͨ��
d.װ��C������ƿӦ���ڱ�ˮ����ȴ
e.D��U�ι���ʢ�ŵĿ����Ǽ�ʯ��
�۴ӻ�ѧƽ���ƶ��Ƕȷ�������Ӧ��ͨˮ��ȴ��Ŀ��Ϊ______��
��4��GET��˾������Li-SO2Cl2���õ�أ���ʾ��ͼ��ͼ��ʾ��
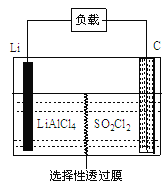
��֪��ط�ӦΪ��2Li + SO2Cl2=" 2LiCl" + SO2�������ع���ʱ�������ĵ缫��ӦʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ��(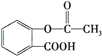 )�dz��õĽ�����ʹҩ������˵������ȷ����( )
)�dz��õĽ�����ʹҩ������˵������ȷ����( )
A.1mol��˾ƥ�ֿ�����3molNaOH��Ӧ
B.��˾ƥ����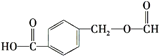 ��Ϊͬ���칹��
��Ϊͬ���칹��
C.��˾ƥ�ֿ��Է���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
D.1mol��˾ƥ�ֿ�����5molH2�����ӳɷ�Ӧ��Ҳ����1mol̼�����Ʒ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ���ķ�ӦX+3Y![]() 2Z�ֱ��ڢ١��ڡ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ��Ϊc(X)=c(Y)=0.100molL-1��c(Z)=0molL-1����Ӧ��X��Ũ����ʱ��仯��ͼ��ʾ���ڡ�����ٱȽ�ֻ��һ��ʵ��������ͬ������˵������ȷ����
2Z�ֱ��ڢ١��ڡ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ��Ϊc(X)=c(Y)=0.100molL-1��c(Z)=0molL-1����Ӧ��X��Ũ����ʱ��仯��ͼ��ʾ���ڡ�����ٱȽ�ֻ��һ��ʵ��������ͬ������˵������ȷ����
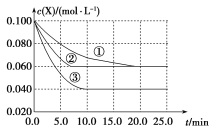
A.��Ӧ0��5.0minʵ��۵ķ�Ӧ�������B.�����ڵķ�Ӧ���ȴﵽƽ��
C.����ٱȽϣ��ڿ���ѹǿ����D.�÷�Ӧ������Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�йط�Ӧ�������仯��ͼ���Իش��������⡣
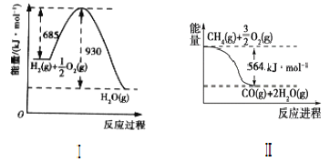
��1������ͼ��д������Ȼ�ѧ����ʽ��____��
��2��д��CH4(g)��H2O(g)��Ӧ��ȡCO(g)��H2(g)���Ȼ�ѧ����ʽ��____��
��3���ڣ�2���ķ�Ӧ�У���صĻ�ѧ�������������±���ʾ���ж�H2O(g)��O��H�ļ���Ϊ___��
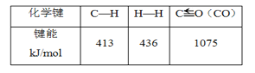
��4���ԱȽ�����������H�Ĵ�С����������������������=����
��C��s��+CO2��g��=2CO��g����H1��C��s��+![]() O2��g��=CO��g����H2����H1___��H2��
O2��g��=CO��g����H2����H1___��H2��
��CH4(g)+H2O(g)=CO(g)+3H2(g)��H3��CH4(g)+H2O(l)=CO(g)+3H2(g)��H4������H3___��H4
��2H2(g)+O2(g)=2H2O(1)��H4��2H2(g)+O2(g)=2H2O(g)��H5������H4___��H5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3CH2OH�� ![]() ��Ϊͬ���칹�壬���������ʷֱ�������м�����Ͻ��м�⣬��ʾ�����ź���ȫ��ͬ����
��Ϊͬ���칹�壬���������ʷֱ�������м�����Ͻ��м�⣬��ʾ�����ź���ȫ��ͬ����
A.���ϣԪ�ط�����B.���������C.�˴Ź�����D.������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com