
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:SO2(g) +Cl2(g)+ SCl2(g)![]() 2SOCl2(g) △H=a kJ·mol-1
2SOCl2(g) △H=a kJ·mol-1
SO2Cl2(g)+ SCl2(g)![]() 2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2(g)![]() SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
(2)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5+ 10SO2↑,若生成1molSO2,则转移电子的物质的量为_____mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
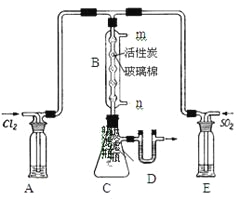
![]()
![]()
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为_____。
②上图所示的装置说法正确的是_____(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为______。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,
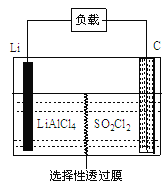
已知电池反应为:2Li + SO2Cl2=" 2LiCl" + SO2↑;则电池工作时,正极的电极反应式为_______。
【答案】a-b c(SO2Cl2)/[c(SO2)·c(Cl2)] 2 MnO2+4HCl(浓)![]() MnCl2+ Cl2↑ +2H2O bde 冷凝、降温均有利于SO2Cl2生成 SO2Cl2+ 2e- = 2Cl-+ SO2↑
MnCl2+ Cl2↑ +2H2O bde 冷凝、降温均有利于SO2Cl2生成 SO2Cl2+ 2e- = 2Cl-+ SO2↑
【解析】
试题(1)反应①SO2(g) +Cl2(g)+ SCl2(g)![]() 2SOCl2(g)减去反应②SO2Cl2(g)+ SCl2(g)
2SOCl2(g)减去反应②SO2Cl2(g)+ SCl2(g)![]() 2SOCl2(g)可得:SO2(g) + Cl2(g)
2SOCl2(g)可得:SO2(g) + Cl2(g)![]() SO2Cl2(g),根据盖斯定律可得△H =△H 1—△H2=(a-b)kl/mol;根据平衡常数的概念可得K= c(SO2Cl2)/[c(SO2)·c(Cl2)]。
SO2Cl2(g),根据盖斯定律可得△H =△H 1—△H2=(a-b)kl/mol;根据平衡常数的概念可得K= c(SO2Cl2)/[c(SO2)·c(Cl2)]。
(2)SO2Cl2中S元素的化合价为+6,SO2中S元素的化合价为+4,所以SO2Cl2转化为SO2,化合价降低2价,则SO2与电子转移的对应关系为:SO2~ 2e,所以生成1molSO2,转移电子的物质的量为2mol。
(3)①MnO2与浓盐酸加热生成MnCl2、Cl2、H2O,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+ Cl2↑ +2H2O。
MnCl2+ Cl2↑ +2H2O。
②a、因为磺酰氯遇水发生剧烈水解,所以A、E两处洗气瓶的作用是干燥SO2、Cl2,盛放的干燥剂为浓硫酸,故a错误;b、B处反应管内五球中玻璃棉上的活性炭对氯气与二氧化硫的反应起到催化作用,故b正确;c、为了使气体充分冷却,B处反应管冷却水应从低处进高处出,即冷却水应从n接口通入,故c错误;d、SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,为放热反应,所以装置C处吸滤瓶放在冰水中冷却,降低温度,促进平衡向正反应方向移动,提高产物的产率,故d正确;e、因为磺酰氯遇水发生剧烈水解,所以D处盛放的是固体干燥剂,可能是碱石灰,故e正确。
SO2Cl2(g) △H <0,为放热反应,所以装置C处吸滤瓶放在冰水中冷却,降低温度,促进平衡向正反应方向移动,提高产物的产率,故d正确;e、因为磺酰氯遇水发生剧烈水解,所以D处盛放的是固体干燥剂,可能是碱石灰,故e正确。
③因为SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,为放热反应,所以反应管通水冷却能促使平衡向正反应方向移动,有利于SO2Cl2生成。
SO2Cl2(g) △H <0,为放热反应,所以反应管通水冷却能促使平衡向正反应方向移动,有利于SO2Cl2生成。
(4)电池工作时,正极上SO2Cl2发生得电子的反应,所以电极方程式为:SO2Cl2+ 2e- = 2Cl-+ SO2↑。


 能力评价系列答案
能力评价系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+) < c(Cl-)
B.向 NH4Cl 溶液中通 NH3,则 c(![]() ) >c(Cl-) > c(OH-)> c(H+)
) >c(Cl-) > c(OH-)> c(H+)
C.室温下,c(![]() )相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
)相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
D.已知 pKa= -lgKa,pKa(HF)=3.1,pKa(C6H5COOH) = 4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
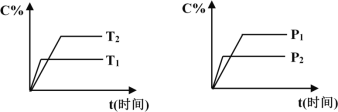
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子材料的结构简式如图所示:已知该高分子材料是由三种单体聚合而成的,下列与该高分子材料相关的说法正确的是( )
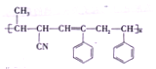
A. 该高分子材料是体型高分子,合成它的反应是加聚反应
B. 形成该高分子材料的单体![]() 中,所有原子可能处于同一平面内
中,所有原子可能处于同一平面内
C. 三种单体中有两种有机物互为同系物
D. 三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气体有机物A是一种重要的化工原料,其在标准状况下的密度为![]() 。已知乙烯与乙酸在一定条件下能发生反应生成乙酸乙酯。
。已知乙烯与乙酸在一定条件下能发生反应生成乙酸乙酯。
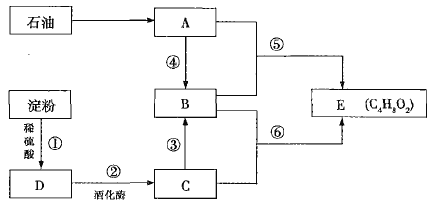
(1)C中的官能团名称是________;⑥的反应类型是________。
(2)反应⑤的化学反应方程式为___________________________________________(反应条件忽略)。
(3)下列说法正确的是________(填序号)。
A.淀粉发生反应①后直接加入银氨溶液可以检验D的生成
B.B、C、E可以用饱和碳酸钠溶液鉴别
C.反应⑥中浓硫酸的作用是催化剂和吸水剂
D.①和④的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:
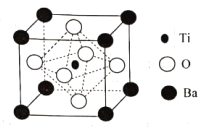
Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列说法正确的是( )
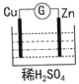
A.正极发生氧化反应
B.SO![]() 向负极移动
向负极移动
C.电子是由Zn片通过溶液流向Cu片
D.正极的电极反应式为Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到2020年我国单位国内生产总值二氧化碳排放比2005年下降40%~45%,作为约束性指标纳入国民经济和社会发展的中长期规划,将![]() 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。![]() 转化成有机物的例子很多,如
转化成有机物的例子很多,如
①![]()
②![]()
③![]()
④![]()
对以上反应,下列说法正确的是( )
A.最节能的是反应①
B.因为![]() 有毒,故反应②无应用价值
有毒,故反应②无应用价值
C.反应③的原子利用率为100%
D.反应④是工业生产乙烯的主要方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com