
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:
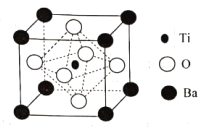
Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
【答案】3d24s2 d ABC sp2 < N原子上有一对孤对电子,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力 Na>O>N 6 ![]() ×107
×107
![]()
【解析】
(1) Ti是22号元素,根据原子构造原理可得其核外电子排布式,得到基态Ti原子的价电子排布式,并根据元素原子结构与元素在周期表的位置关系判断其所属区域;
(2)KH2PO4是盐,属于离子晶体,含离子键,在阴离子H2PO4-中含有P=O键、O-H键,可形成氢键;
(3)根据N、O原子间形成的电子对分析原子杂化,并结合孤电子对与成键电子对之间的作用力情况判断键角大小;
(4)从元素的+1价离子的稳定性大小分析I2大小;
(5)根据晶胞在各种微粒的空间构型及相对位置判断Ti的配位体数目;用均摊法计算一个晶胞中含有的各种元素的原子个数,计算晶胞的质量,利用m=ρV、及边长V= L3计算晶胞边长,最后根据Ba与O原子的位置在面对角线的一半就可计算出两个微粒间的距离。
(1)Ti的原子序数为22,则基态原子的价电子排布式为3d24s2,位于第四周期IVB族,属于d区,故答案为3d24s2;d;
(2) KH2PO4是盐,属于离子晶体,含离子键,在阴离子H2PO4-中含有P=O键、2个O-H键,故可可形成氢键,故合理选项是ABC;
(3)NO2-的中心原子的价层电子对数为3,所以NO2-中的N原子采用sp2杂化,N原子的3个杂化轨道,其中一个被孤电子对占有,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力,所以键角小于120°,故答案为sp2;<;N原子上有一对孤对电子,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力;
(4) 由于Na+是最外层8个电子的稳定结构,气态基态Na+从8电子稳定结构再失去一个电子最难,气态基态O+从2p3半充满较稳定结构再失去一个电子较难。所以Na+ 的第二电离能I2最大,N+最小,因此三种元素的第二电离能(I2)由大到小的顺序为Na>O>N;
(5)根据晶胞结构示意图可知:Ti位于晶胞中心,O原子位于晶胞六个面心上,Ba位于晶体的8个顶点上,所以Ti的配位体数目是6;在一个晶胞中含有的各种元素的原子个数Ti:1×1=1;Ba:![]() ×8=1,O:
×8=1,O:![]() ×6=3,即一个晶胞中含有1个BaTiO3,其质量m=
×6=3,即一个晶胞中含有1个BaTiO3,其质量m=![]() g,由于晶胞的密度是ρg/cm3,所以晶胞的体积V=
g,由于晶胞的密度是ρg/cm3,所以晶胞的体积V=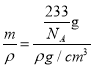 =
=![]() cm3,则晶胞的边长L=
cm3,则晶胞的边长L=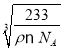 cm=
cm=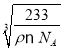 ×107nm,最近的Ba原子和O原子位于面对角线的一半位置,所以最近的Ba原子和O原子之间的距离为a=
×107nm,最近的Ba原子和O原子位于面对角线的一半位置,所以最近的Ba原子和O原子之间的距离为a=![]() L=
L=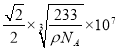 nm,故答案为6;
nm,故答案为6;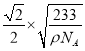 ×107。
×107。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
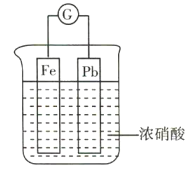
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() 的
的![]() 二元酸的正盐
二元酸的正盐![]() 溶液中含A原子的粒子所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
溶液中含A原子的粒子所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
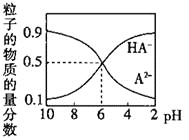
A.NaHA溶液显碱性
B.![]() 时,
时,![]()
C.![]() 时,
时,![]()
D.室温下,![]() 的电离平衡常数
的电离平衡常数![]() 为
为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:SO2(g) +Cl2(g)+ SCl2(g)![]() 2SOCl2(g) △H=a kJ·mol-1
2SOCl2(g) △H=a kJ·mol-1
SO2Cl2(g)+ SCl2(g)![]() 2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2(g)![]() SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
(2)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5+ 10SO2↑,若生成1molSO2,则转移电子的物质的量为_____mol。
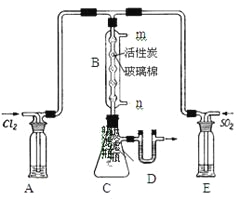
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
![]()
![]()
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为_____。
②上图所示的装置说法正确的是_____(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为______。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,
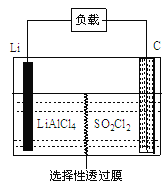
已知电池反应为:2Li + SO2Cl2=" 2LiCl" + SO2↑;则电池工作时,正极的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
图Ⅰ 图Ⅱ
图Ⅱ
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D. 200 ℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的反应X+3Y![]() 2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
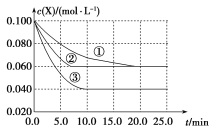
A.反应0~5.0min实验③的反应速率最快B.条件②的反应最先达到平衡
C.②与①比较,②可能压强更大D.该反应的正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表第四周期共有18种元素。回答下列问题:
(l)第四周期元素的基态原子中,最高能层中的s轨道上只有一个电子的元素有_____;
镍元素基态原子的电子排布式为____;p区元素第一电离能由大到小的前三种元素依次为____;
(2)GaBr3、GeBr4、AsBr3、AsBr5中,中心原子的轨道杂化类型为sp3的化合物是____;分子的立体构型为平面三角形的化合物是_____;AsBr5的分子构型为 ,则AsBr5是_____(填“极性”或“非极性”)分子。
,则AsBr5是_____(填“极性”或“非极性”)分子。
(3)已知GaF3的沸点为19.5℃、GaC13的沸点为201.3℃、GaBr3的沸点为292℃,导致沸点如此变化的原因是___________.
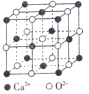
(4)Ca、CaO、CaC12等含钙物质的焰色均为砖红色,焰色形成的原因是钙元素在一定条件下产生原子_______光谱。CaO晶胞如图所示,CaO晶体中Ca2+的配位数为____;若CaO的密度为dg/cm3,则CaO的晶胞参数a=__________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.甘氨酸和丙氨酸混合物脱水成肽,最多可生成4种二肽
C.萘环(![]() )上的一个H原子被—C4H9取代后的产物共有6种
)上的一个H原子被—C4H9取代后的产物共有6种
D.C3H6和C4H8一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是![]()
A.凡是离子化合物在离子方程式中都要以离子来表示
B.离子互换反应总是向着溶液中离子浓度减小的方向进行
C.酸碱中和反应的实质是![]() 和
和![]() 结合生成水,故酸碱中和反应的离子方程式都是
结合生成水,故酸碱中和反应的离子方程式都是![]()
D.复分解反应必须具备离子反应生成的三个条件才能进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com