
【题目】元素周期表第四周期共有18种元素。回答下列问题:
(l)第四周期元素的基态原子中,最高能层中的s轨道上只有一个电子的元素有_____;
镍元素基态原子的电子排布式为____;p区元素第一电离能由大到小的前三种元素依次为____;
(2)GaBr3、GeBr4、AsBr3、AsBr5中,中心原子的轨道杂化类型为sp3的化合物是____;分子的立体构型为平面三角形的化合物是_____;AsBr5的分子构型为 ,则AsBr5是_____(填“极性”或“非极性”)分子。
,则AsBr5是_____(填“极性”或“非极性”)分子。
(3)已知GaF3的沸点为19.5℃、GaC13的沸点为201.3℃、GaBr3的沸点为292℃,导致沸点如此变化的原因是___________.
(4)Ca、CaO、CaC12等含钙物质的焰色均为砖红色,焰色形成的原因是钙元素在一定条件下产生原子_______光谱。CaO晶胞如图所示,CaO晶体中Ca2+的配位数为____;若CaO的密度为dg/cm3,则CaO的晶胞参数a=__________nm。
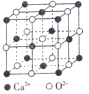
【答案】 K、Cr、Cu 1s22s22p63s23p63d84s2(或[Ar] 3d84s2) Kr>Br>As GeBr4、AsBr3 GaBr3 非极性 GaF3、GaCl3、GaBr3均是分子晶体,范德华力随着相对分子质量的增大而增大,故沸点依次升高 发射 6 ![]()
【解析】(1)考查核外电子排布规律、电子排布式、第一电离能的规律,第四周期中最高能层的s轨道上只有1个电子,注意电子稳定状态,因此有K、Cr、Cu;Ni位于第四周期VIII族,28号元素,因此核外电子排布式为1s22s22p63s23p63d84s2(或[Ar] 3d84s2);同周期从左向右第一电离能增大,但IIA>IIIA、VA>VIA,因此由大到小前三种元素依次为Kr>Br>As;(2)考查杂化类型的判断、空间构型、(非)极性分子的判断,GaBr3中心原子有3个σ键,孤电子对数为(3-3×1)/2=0,因此杂化类型为sp2,GeBr4中心原子有4个σ键,孤电子对数为(4-4×1)/2=0,杂化类型为sp4,AsBr3中心原子为3个σ键,孤电子对数为(5-3×1)/2=1.杂化类型为sp3,AsBr5中心原子是5个σ键,孤电子对数为(5-5×1)/2=0,杂化类型为sp3d,空间构型分别是平面三角形、正四面体、三角锥形、三角双锥,AsBr5是对称结构,因此属于非极性分子;(3)考查晶体熔沸点比较,三种物质沸点较低,属于分子晶体,范德华力随着相对分子质量的增大而增大,故沸点依次升高 ; (4)考查配位数、晶胞的计算,焰色形成原因是钙元素在一定条件下产生原子的发射光谱,CaO是离子键,距离某离子最近的异性离子的个数,根据晶胞,Ca2+的配位数为6,Ca2+位于晶胞的顶点和面心,个数为8×1/8+6×1/2=4,O2-位于晶胞的棱上和体心,个数为12×1/4+1=4,因此晶胞的质量为4×56/NAg,晶胞的体积为(a×10-7)3,根据密度的定义,d=4×56/[ NA×(a×10-7)3] ,解得a=![]() 。
。


科目:高中化学 来源: 题型:
【题目】有铜和氧化铁的混合物ag,当慢慢滴入![]() 的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解,若将ag该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
A.等于![]()
![]() B.大于
B.大于![]()
![]()
C.大于![]() D.等于
D.等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子材料的结构简式如图所示:已知该高分子材料是由三种单体聚合而成的,下列与该高分子材料相关的说法正确的是( )
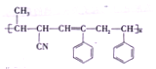
A. 该高分子材料是体型高分子,合成它的反应是加聚反应
B. 形成该高分子材料的单体![]() 中,所有原子可能处于同一平面内
中,所有原子可能处于同一平面内
C. 三种单体中有两种有机物互为同系物
D. 三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:
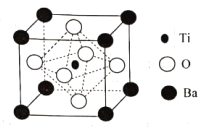
Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3,
(1)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_____,与CO互为等电子体的分子的电子式为______________。
(2)硝酸钾中NO3-的空间构型_____,与NO3-互为等电子体的一种非极性分子化学式为_____。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,

写出该反应的化学方程式____________________。 若两个最近的Fe原子间的距离为s cm,则该晶体的密度是__________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列说法正确的是( )
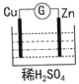
A.正极发生氧化反应
B.SO![]() 向负极移动
向负极移动
C.电子是由Zn片通过溶液流向Cu片
D.正极的电极反应式为Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
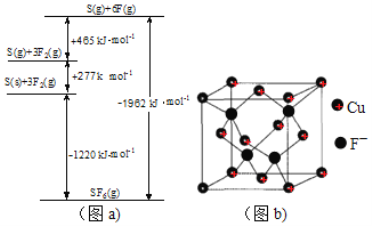
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为______。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______、______
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在______(填序号):
A.离子键B.σ键C.π键D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJmol-1,S-F的键能为______kJmol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF比CuCl熔点高的原因是______;
②已知NA为阿伏加德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
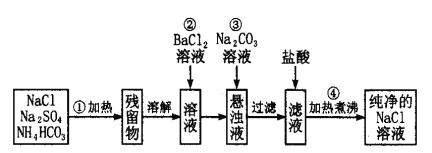
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
请回答下列问题:
(1)操作①可在什么仪器中进行?(填序号)__________。
A. 烧瓶 B. 坩埚 C. 容量瓶
(2)操作②发生的离子反应方程式为______________________________。
(3)操作②是否可改为加硝酸钡溶液?为什么?______________________。
(4)进行操作②后,如何判断SO42-已除尽,方法是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com