
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
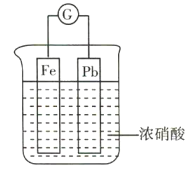
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是
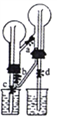
A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一种工业合成氨的简易流程图如图:
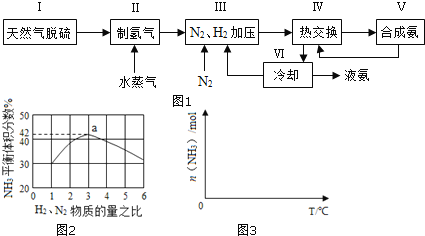
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式为: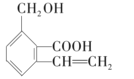
(1)请写出该有机物具有的官能团名称:
①___________;②___________;③____________。
(2)该有机物属于___________________________(填选项字母)。
①酯类化合物 ②多官能团有机物 ③芳香烃 ④烃的衍生物 ⑤醇类化合物 ⑥芳香化合物 ⑦烯烃
A.①②③④ B.①②④⑦ C.②④⑤⑥ D.②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO![]() 、Clˉ、CO
、Clˉ、CO![]() 和HCO
和HCO![]() 离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸):
离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸):
①向溶液中滴加少量![]() 溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1 AgNO3溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液A中一定存在H+、SO![]() 和Clˉ
和Clˉ
B.溶液A中不存在Mg2+、CO![]() 和HCO
和HCO![]() ,不能确定Na+的存在
,不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可用NaOH溶液判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷![]() 、锑
、锑![]() 、铋
、铋![]() 、镆
、镆![]() 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为______。已知:
的中子数为______。已知:![]() (
(![]() ,白磷)=
,白磷)=![]() (
(![]() ,黑磷)
,黑磷) ![]() ;
;![]() (
(![]() ,白磷)=
,白磷)=![]() (
(![]() ,红磷)
,红磷) ![]() ; 由此推知,其中最稳定的磷单质是______。
; 由此推知,其中最稳定的磷单质是______。
(2)氮和磷氢化物性质的比较:热稳定性:![]() ______
______![]() (填“>”“<”)。 沸点:
(填“>”“<”)。 沸点:![]() ______
______![]() (填“>”“<”),判断依据是______。
(填“>”“<”),判断依据是______。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是______(填序号)。
反应产物的推断正确的是______(填序号)。
a.不能与![]() 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应
(4)![]() 能发生较烈的水解,生成难溶的
能发生较烈的水解,生成难溶的![]() ,写出该反应的化学方程式 ______________,因此,配制
,写出该反应的化学方程式 ______________,因此,配制![]() 溶液应注意_____________。
溶液应注意_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为某机物与对应试剂的反应现象或是否反应,则这种有机物可能是( )
试剂 | 钠 | 溴的四氯化碳溶液 | 新制 | 乙酸 |
现象或是否反应 | 放出气体 | 褪色 | 逐渐溶解 | 不反应 |
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com