
【题目】氮、磷、砷![]() 、锑
、锑![]() 、铋
、铋![]() 、镆
、镆![]() 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为______。已知:
的中子数为______。已知:![]() (
(![]() ,白磷)=
,白磷)=![]() (
(![]() ,黑磷)
,黑磷) ![]() ;
;![]() (
(![]() ,白磷)=
,白磷)=![]() (
(![]() ,红磷)
,红磷) ![]() ; 由此推知,其中最稳定的磷单质是______。
; 由此推知,其中最稳定的磷单质是______。
(2)氮和磷氢化物性质的比较:热稳定性:![]() ______
______![]() (填“>”“<”)。 沸点:
(填“>”“<”)。 沸点:![]() ______
______![]() (填“>”“<”),判断依据是______。
(填“>”“<”),判断依据是______。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是______(填序号)。
反应产物的推断正确的是______(填序号)。
a.不能与![]() 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应
(4)![]() 能发生较烈的水解,生成难溶的
能发生较烈的水解,生成难溶的![]() ,写出该反应的化学方程式 ______________,因此,配制
,写出该反应的化学方程式 ______________,因此,配制![]() 溶液应注意_____________。
溶液应注意_____________。
【答案】第四周期第VA族 173 黑磷 > > ![]() 分子间存在氢键 b、c SbCl3+H2O
分子间存在氢键 b、c SbCl3+H2O![]() SbOCl
SbOCl![]() +2HCl 加盐酸,抑制水解
+2HCl 加盐酸,抑制水解
【解析】
(1)As位于第四周期第VA族,中子数=质量数-质子数;
能量越低越稳定;
(2)元素的非金属性越强,其氢化物越稳定;
分子晶体熔沸点与分子间作用力和氢键有关,能形成分子间氢键的氢化物熔沸点较高;
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应产物为PH4I,相当于铵盐,具有铵盐结构性质;
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,根据元素守恒知,还生成HCl;配制SbCl3溶液要防止其水解,其水溶液呈酸性,所以酸能抑制水解。
(1)As位于第四周期第VA族,中子数=质量数-质子数=288-115=173;
能量越低越稳定,
P(s,白磷)=P(s,黑磷)△H=-39.3 kJ?mol-1①
P(s,白磷)=P(s,红磷)△H=-17.6kJ·mol-1②
将方程式①-②得P(s,红磷)=P(s,黑磷)△H=(-39.3+17.6)kJ·mol-1=-21.7kJ·mol-1,则能量:红磷>黑磷,则黑磷稳定;
(2)元素的非金属性越强,其氢化物越稳定;
非金属性N>P,所以热稳定性:NH3>PH3;
N2H4能形成分子间氢键、P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4;
分子晶体熔沸点与分子间作用力和氢键有关,能形成分子间氢键的氢化物熔沸点较高;
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应产物为PH4I,相当于铵盐,具有铵盐结构性质,
a.铵盐能和NaOH发生复分解反应,所以PH4I能与NaOH反应,故错误;
b.铵盐中存在离子键和共价键,所以PH4I中含离子键、共价键,故正确;
c.铵盐都易发生水解反应,所以PH4I能与水反应,故正确;
故选bc;
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,根据元素守恒知,还生成HCl,反应方程式为SbCl3+H2O![]() SbOCl+2HCl;配制SbCl3溶液要防止其水解,其水溶液呈酸性,所以酸能抑制水解,则配制该溶液时为防止水解应该加入盐酸。
SbOCl+2HCl;配制SbCl3溶液要防止其水解,其水溶液呈酸性,所以酸能抑制水解,则配制该溶液时为防止水解应该加入盐酸。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是
A.苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B.KCl和MnO2的混合物经溶解、过滤、洗涤、干燥,可分离出MnO2
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加AgNO3溶液、稀HNO3和NaNO2溶液,可检验火柴头是否含有氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
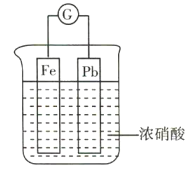
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣![]() 溶液
溶液![]() 绿矾
绿矾![]() 铁黄
铁黄
已知:FeS2和铁黄均难溶于水
下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O=15Fe2++2SO![]() +16H+
+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的Na2CO3浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是
①CH3CH(OH)COOH ②HOOCCOOH ③CH3CH2COOH ④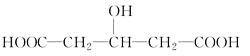
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用
是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度。请回答:
和NO制备ClNO并测定其纯度。请回答:
I.甲组的同学拟制备原料气NO和![]() ,制备装置如下图所示:
,制备装置如下图所示:
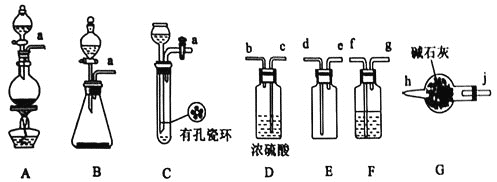
(1)若制备![]() 发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
(2)欲收集一瓶干燥纯净的氯气,选择装置其连接顺序为:![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() 按气流方向,用小写字母表示
按气流方向,用小写字母表示![]() ,其中F装置的作用为________。
,其中F装置的作用为________。
II.乙组同学利用甲组制得的NO和![]() 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
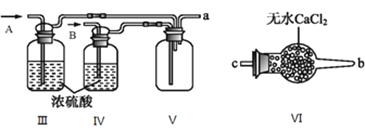
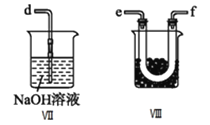
(3)为了使气体充分反应,从A处进入的气体是_______![]() 填
填![]() 或
或![]() 。
。
(4)装置Ⅲ、Ⅳ除可干燥NO、![]() 外,另一个作用是_________________。
外,另一个作用是_________________。
(5)装置Ⅷ的烧杯中盛放的试剂是______![]() 填编号:
填编号:![]() 水
水 ![]() 热水
热水 ![]() 冰水
冰水![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,实验室里用![]() 的盐酸溶液滴定
的盐酸溶液滴定![]() 氨水溶液,若用AG表示溶液的酸度,其表达式为:
氨水溶液,若用AG表示溶液的酸度,其表达式为: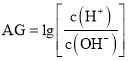 ,滴定曲线如图所示,下列说法正确的是
,滴定曲线如图所示,下列说法正确的是![]()
![]()
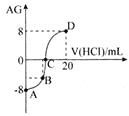
A.D点溶液中离子浓度关系为:![]()
B.C点加入盐酸的体积为10mL
C.若B点加入的盐酸溶液体积为5mL,所得溶液中:![]()
D.滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):![]() 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com