
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是
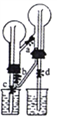
A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
科目:高中化学 来源: 题型:
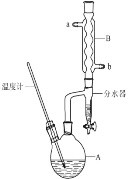
【题目】正丁醚常作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。
请回答:
(1)步骤①中还需要加入____,加热A前,需向B中通入水,____(填“a”或“b”)是B的出水口。
(2)步骤③的目的是初步洗去____,振摇后静置,粗产物应从分液漏斗的____(填“上口”或“下口”)分离出。
(3)步骤④中最后一次水洗的作用为____。
(4)步骤⑤中,加热蒸馏时应收集(填选项字母)____左右温度的馏分。
a.100℃ b.117℃ c.135℃ d.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满液体时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分是____。
(6)本实验中,正丁醚的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是![]() 的两个性质实验,下列有关说法中正确的是
的两个性质实验,下列有关说法中正确的是![]()

A. 两个实验均表现了![]() 易溶于水
易溶于水
B. 两个实验均表现了![]() 易挥发
易挥发
C. 两个实验均表现了![]() 是碱性气体
是碱性气体
D. 两个实验均表现了![]() 是还原性气体
是还原性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是
A.苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B.KCl和MnO2的混合物经溶解、过滤、洗涤、干燥,可分离出MnO2
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加AgNO3溶液、稀HNO3和NaNO2溶液,可检验火柴头是否含有氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。可由CO和水蒸气反应制备,其能量变化如图所示。
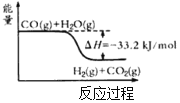
(1)该反应为可逆反应。在800℃时,若CO的起始浓度为2.0mol·L-1,水蒸气的起始浓度为3.0mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2mol·L-1,则此反应的平衡常数为___,随着温度升高该反应的化学平衡常数的变化趋势是___。(填“变大”、“变小”或“不变”)
(2)某温度下,该反应的平衡常数为K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是(________)
。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是(________)
起始浓度 | 甲 | 乙 | 丙 |
c(H2O)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol·L-1
D.平衡时,乙中H2O的转化率大于25%
(3)一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,达到平衡后:
2NH3(g) ΔH<0,达到平衡后:
①加催化剂,v(正)、v(逆)都发生变化,且变化的倍数___(填“相等”或“不相等”)。
② 缩小体积使体系压强增大,则v(正)__,v(逆)__(填“增大”、“减小”或“不变”),v(正)变化的倍数___v(逆)变化的倍数(填“大于”、“小于”或“等于”)。
③恒温恒压,再通入一定量的He,达到新平衡时,N2的转化率__,c(H2)将__(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]() 含
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() ,下列分析错误的是
,下列分析错误的是![]()
![]()
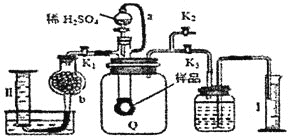
A.干燥管b中装入碱石灰
B.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
C.测定总体积后,关闭![]() ,打开
,打开![]() ,可观察到Q气球慢慢缩小,并测出氧气体积
,可观察到Q气球慢慢缩小,并测出氧气体积
D.Q气球中产生的气体主要成份![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
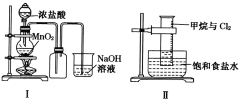
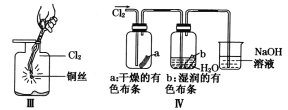
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
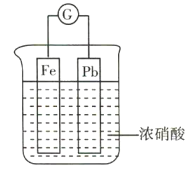
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用
是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度。请回答:
和NO制备ClNO并测定其纯度。请回答:
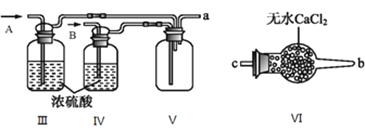
I.甲组的同学拟制备原料气NO和![]() ,制备装置如下图所示:
,制备装置如下图所示:
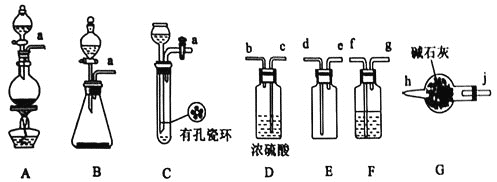
(1)若制备![]() 发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
(2)欲收集一瓶干燥纯净的氯气,选择装置其连接顺序为:![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() 按气流方向,用小写字母表示
按气流方向,用小写字母表示![]() ,其中F装置的作用为________。
,其中F装置的作用为________。
II.乙组同学利用甲组制得的NO和![]() 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
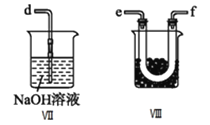
(3)为了使气体充分反应,从A处进入的气体是_______![]() 填
填![]() 或
或![]() 。
。
(4)装置Ⅲ、Ⅳ除可干燥NO、![]() 外,另一个作用是_________________。
外,另一个作用是_________________。
(5)装置Ⅷ的烧杯中盛放的试剂是______![]() 填编号:
填编号:![]() 水
水 ![]() 热水
热水 ![]() 冰水
冰水![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com