
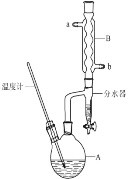
【题目】正丁醚常作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。
请回答:
(1)步骤①中还需要加入____,加热A前,需向B中通入水,____(填“a”或“b”)是B的出水口。
(2)步骤③的目的是初步洗去____,振摇后静置,粗产物应从分液漏斗的____(填“上口”或“下口”)分离出。
(3)步骤④中最后一次水洗的作用为____。
(4)步骤⑤中,加热蒸馏时应收集(填选项字母)____左右温度的馏分。
a.100℃ b.117℃ c.135℃ d.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满液体时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分是____。
(6)本实验中,正丁醚的产率为____。
【答案】沸石(或碎瓷片) a 浓硫酸 上口 洗去有机层中残留的氢氧化钠及中和反应生成的盐 d 正丁醇(或1-丁醇) 34%
【解析】
正丁醇在浓硫酸作用下加热至135℃左右制备正丁醚,浓硫酸稀释过程放热,会出现液体暴沸飞溅,应该先加入正丁醇,再加入浓硫酸,并加入废瓷片防止反应混合液液暴沸,正丁醇易挥发,用冷凝管冷凝回流,提高原料利用率,并收集制备的正丁醚,据此分析解答。
(1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释,应该先加入正丁醇,再加入浓硫酸,并加入沸石(或碎瓷片)防止液体暴沸,加热A前,需向B中通入水,冷凝水的水流方向和气流方向相反,应该下口进,上口出,a是B的出水口;
(2)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,所以步骤③的目的是初步洗去浓硫酸;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇,从分液漏斗的上口倒出;
(3)步骤④中最后一次水洗的目的是为了洗去有机层残留的NaOH及中和反应生成的盐;
(4)步骤⑤中,加热蒸馏的目的是收集正丁醇(或1-丁醇),而正丁醇的沸点为142℃,故应收集142℃左右的馏分,故答案为d;
(5)水器中收集到液体物质,因正丁醇密度比水小且微溶于水,会分为上下两层,上层为正丁醇,下层主要成分为水;
(6)实验前提供的37g正丁醇的物质的量为![]() =0.5mol,根据方程式2CH3CH2CH2CH2OH
=0.5mol,根据方程式2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O可知,理论上生成正丁醚的物质的量为
(CH3CH2CH2CH2)2O+H2O可知,理论上生成正丁醚的物质的量为![]() =0.25mol,质量为0.25mol×130gmol-1=32.5g,根据实验步骤最终实际制得纯净正丁醚11g,因此正丁醚的产率为
=0.25mol,质量为0.25mol×130gmol-1=32.5g,根据实验步骤最终实际制得纯净正丁醚11g,因此正丁醚的产率为![]() ×100%=34%。
×100%=34%。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】CO2是廉价的碳资源,其综合利用具有重要意义。
(1)CO2与CH4经催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+120kJ·mol-1可以制得合成气。
已知上述反应中相关物质所含化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | a | b | c | x |
①x=___。
②分别在恒温密闭容器A(恒容)、B(恒压,体积可变)中,加入CH4和CO2各1mol的混合气体,起始体积均为VL。相同温度下两容器中反应达平衡后吸收热量较多的是___ (填“A”或“B”)。保持A容器的体积和B容器压强不变,写出一种能使A、B两容器中各物质的体积分数相同的方法:___。
③某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行反应,达到平衡时CO2的体积分数为![]() ,该温度下反应的平衡常数为___。
,该温度下反应的平衡常数为___。
(2)CO2可以被NaOH捕获。所得溶液中含碳微粒的分布百分数随pH的变化如图所示。H2CO3的二级电离平衡常数Ka2=___。pH=5.4时,φ(A):φ(B)=___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,一定不存在同分异构体的是
A.异戊二烯与等物质的量的Br2反应
B.邻羟基苯甲酸与NaHCO3溶液反应
C.甲苯与Cl2在一定条件下发生取代反应
D.2-氯丁烷与NaOH乙醇溶液共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
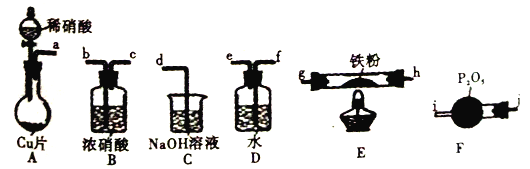
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值.下列叙述正确的是
表示阿伏加德罗常数的值.下列叙述正确的是
A.![]() 与足量
与足量![]() 反应,共生成
反应,共生成![]() ,转移电子的数目为
,转移电子的数目为![]()
B.室温下,![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 离子数目为
离子数目为![]()
C.![]() 聚丙烯中含有双键的数目为
聚丙烯中含有双键的数目为![]()
D.含![]() 的饱和溶液最多可形成胶体粒子数为
的饱和溶液最多可形成胶体粒子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(二元弱酸,分子式为H2C2O4)遍布于自然界,几乎所有的植物都含有草酸钙(CaC2O4)。
(1) 葡萄糖(C6H12O6)与HNO3反应可生成草酸和NO,其化学方程式为________。
(2) 相当一部分肾结石的主要成分是CaC2O4。若某人每天排尿量为1.4 L,含0.10 g Ca2+。当尿液中c(C2O42-)>________mol·L-1时,易形成CaC2O4沉淀。[已知Ksp(CaC2O4)=2.3×10-9]
(3) 测定某草酸晶体(H2C2O4·xH2O)组成的实验如下:
步骤1:准确称取0. 550 8 g邻苯二甲酸氢钾(结构简式为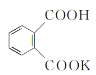 )于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.50 mL。
)于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.50 mL。
步骤2:准确称取0.151 2 g草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用步骤1中所用NaOH溶液滴定至终点(H2C2O4+2NaOH===Na2C2O4+2H2O),消耗NaOH溶液的体积为20.00 mL。
①“步骤1”的目的是____________________________________。
②计算x的值(写出计算过程)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为100的烷烃的分子式是____________________________。
(2)立方烷的结构简式为![]() ,其一氯代物有_____________种,它的六氯代物有__________________种。
,其一氯代物有_____________种,它的六氯代物有__________________种。
(3)下列物质的沸点按由高到低的顺序排列正确的是___________________。
①![]() ②
②![]() ③
③![]() ④
④![]()
A.②④①③ B.④②①③ C.④③②① D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是
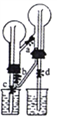
A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com