
【题目】(1)相对分子质量为100的烷烃的分子式是____________________________。
(2)立方烷的结构简式为![]() ,其一氯代物有_____________种,它的六氯代物有__________________种。
,其一氯代物有_____________种,它的六氯代物有__________________种。
(3)下列物质的沸点按由高到低的顺序排列正确的是___________________。
①![]() ②
②![]() ③
③![]() ④
④![]()
A.②④①③ B.④②①③ C.④③②① D.②④③①
【答案】![]() 1 3 A
1 3 A
【解析】
(1)烷烃的通式是![]() ,据此列式计算;
,据此列式计算;
(2)立方烷结构对称,含有1种H,二氯代物有一条棱、面对角线、体对角线上3种位置,据此分析判断;
(3)烷烃的沸点随着分子中碳原子数的增加逐渐升高;碳原子数相同的烃,支链越多,熔沸点越低,据此分析排序。
(1)烷烃的通式是![]() ,设C原子数为n,则12n+2n+2=100,解得n=7,则相对分子质量为100的烷烃的分子式是C7H16,故答案为:C7H16;
,设C原子数为n,则12n+2n+2=100,解得n=7,则相对分子质量为100的烷烃的分子式是C7H16,故答案为:C7H16;
(2)根据立方烷的结构简式可知,该物质是高度对称的,分子中所有H原子等效,有1种等效H,所以其一氯代物只有1种;二氯代物有一条棱、面对角线、体对角线上3种位置,即二氯代物有3种,分子中共含有8个H原子,则六氯代物与二氯代物的同分异构体数目相同,同分异构体数目为3,故答案为:1;3;
(3)烷烃的沸点随着分子中碳原子数的增加逐渐升高;碳原子数相同的烃,支链越多,熔沸点越低。①、③中碳原子都是4个,①无支链,③中有支链,沸点①![]() ③;②、④中碳原子数都是5,②无支链,④中有支链,沸点②
③;②、④中碳原子数都是5,②无支链,④中有支链,沸点②![]() ④;②、④中碳原子数为5,比①、③中碳原子数都多,则沸点较高,故沸点由高到低的排列顺序是②④①③,故答案为:A。
④;②、④中碳原子数为5,比①、③中碳原子数都多,则沸点较高,故沸点由高到低的排列顺序是②④①③,故答案为:A。


科目:高中化学 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用k表示).下表是25℃下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.96×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2SO3 | H2SO3 HSO3- | K1=1.54×10-2 K2= 1.02×10-7 |
回答下列问题:
(1)CH3COOH、HClO、H2CO3、HCO3-、H2SO3、HSO3-都可看作是酸,其中酸性最强的是_________,最弱的是________________。
(2)向Na2CO3溶液中通入足量的氯气,发生的离子方程式为______________________,向NaClO溶液中通入少量的二氧化硫,发生的离子方程式为____________________________________。
(3)求25℃时,1.2mol/L 的NaClO溶液pH=____________(己知:lg2=0.3),0.10mol/L的CH3COOH溶液中的c(H+)=______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为
A.1.12L B.2.24L C.3.36L D.4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
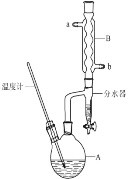
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。
请回答:
(1)步骤①中还需要加入____,加热A前,需向B中通入水,____(填“a”或“b”)是B的出水口。
(2)步骤③的目的是初步洗去____,振摇后静置,粗产物应从分液漏斗的____(填“上口”或“下口”)分离出。
(3)步骤④中最后一次水洗的作用为____。
(4)步骤⑤中,加热蒸馏时应收集(填选项字母)____左右温度的馏分。
a.100℃ b.117℃ c.135℃ d.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满液体时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分是____。
(6)本实验中,正丁醚的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原铁粉主冶惊痫、癫狂、脚气冲心、贫血等。某兴趣小组用氢气和碳酸亚铁反应制取还原铁粉并检验其他产物,实验装置如图![]() 部分支持装置省略
部分支持装置省略![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
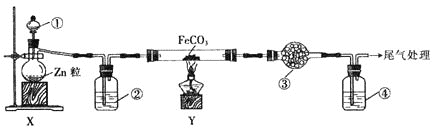
A.![]() 、
、![]() 、
、![]() 、
、![]() 中依次盛放稀
中依次盛放稀![]() 、浓
、浓![]() 、无水硫酸铜、澄清石灰水
、无水硫酸铜、澄清石灰水
B.装置![]() 、
、![]() 的作用分别是检验
的作用分别是检验![]() ,吸收多余的
,吸收多余的![]()
C.加热Y装置前,应先让蒸馏烧瓶中反应一段时间,排出装置中的空气
D.装置X可直接用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的数值,则下列说法中不正确的是
为阿伏伽德罗常数的数值,则下列说法中不正确的是
![]() 常温下,21g聚乙烯
常温下,21g聚乙烯![]() 中含有氢原子的数目为
中含有氢原子的数目为![]()
![]() 在
在![]() 反应中每生成71g氯气转移的电子数为
反应中每生成71g氯气转移的电子数为![]()
![]() 中含
中含![]() 键数目为
键数目为![]()
![]() 过氧化钠与水反应,若转移
过氧化钠与水反应,若转移![]() 个电子,则产生的氧气为32g
个电子,则产生的氧气为32g
![]() 在
在![]() 的碳酸钠溶液中,
的碳酸钠溶液中,![]() 总数为
总数为![]() .
.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A. 由H和Cl形成共价键的过程:![]()
B. Na2O2用于呼吸面具的供氧剂:2Na2O2+2CO2=2Na2CO3+O2
C. 实验室用NH4Cl和Ca(OH)2的混合物制取氨:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
D. 惰性电极电解饱和食盐水的离子方程式:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是![]() 的两个性质实验,下列有关说法中正确的是
的两个性质实验,下列有关说法中正确的是![]()

A. 两个实验均表现了![]() 易溶于水
易溶于水
B. 两个实验均表现了![]() 易挥发
易挥发
C. 两个实验均表现了![]() 是碱性气体
是碱性气体
D. 两个实验均表现了![]() 是还原性气体
是还原性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
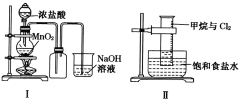
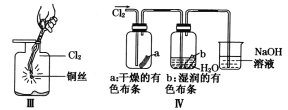
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com