
【题目】设![]() 为阿伏伽德罗常数的数值,则下列说法中不正确的是
为阿伏伽德罗常数的数值,则下列说法中不正确的是
![]() 常温下,21g聚乙烯
常温下,21g聚乙烯![]() 中含有氢原子的数目为
中含有氢原子的数目为![]()
![]() 在
在![]() 反应中每生成71g氯气转移的电子数为
反应中每生成71g氯气转移的电子数为![]()
![]() 中含
中含![]() 键数目为
键数目为![]()
![]() 过氧化钠与水反应,若转移
过氧化钠与水反应,若转移![]() 个电子,则产生的氧气为32g
个电子,则产生的氧气为32g
![]() 在
在![]() 的碳酸钠溶液中,
的碳酸钠溶液中,![]() 总数为
总数为![]() .
.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
![]() 聚乙烯的最简式为
聚乙烯的最简式为![]() ,根据聚乙烯的最简式计算出21g聚乙烯中含有的H原子的物质的量;
,根据聚乙烯的最简式计算出21g聚乙烯中含有的H原子的物质的量;
![]() 反应
反应![]() 浓
浓![]() 中,
中,![]() 中Cl元素由
中Cl元素由![]() 价变为
价变为![]() 价,HCl中Cl元素由
价,HCl中Cl元素由![]() 价变为0价,由方程式可知当有6molHCl参加反应时,有5mol被氧化,转移5mol电子,生成
价变为0价,由方程式可知当有6molHCl参加反应时,有5mol被氧化,转移5mol电子,生成![]() ,以此进行计算;
,以此进行计算;
![]() 氨气分子中含有3个氮氢键,
氨气分子中含有3个氮氢键,![]() 氨气的物质的量为
氨气的物质的量为![]() ,含有
,含有![]() 氮氢键;
氮氢键;
![]() 过氧化钠与水反应中,过氧化钠既是氧化剂也是还原剂,且过氧化钠中氧元素的化合价为
过氧化钠与水反应中,过氧化钠既是氧化剂也是还原剂,且过氧化钠中氧元素的化合价为![]() 价,则生成1mol氧气转移了2mol电子,据此进行计算;
价,则生成1mol氧气转移了2mol电子,据此进行计算;
![]() 在
在![]() 的碳酸钠溶液中,
的碳酸钠溶液中,![]() 部分水解,导致溶液中碳酸根离子数目减少。
部分水解,导致溶液中碳酸根离子数目减少。
![]() 聚乙烯
聚乙烯![]() 的最简式为
的最简式为![]() ,21g聚乙烯中含有最简式
,21g聚乙烯中含有最简式![]() 的物质的量为:
的物质的量为:![]() ,含有H原子的物质的量为
,含有H原子的物质的量为![]() ,含有氢原子的数目为
,含有氢原子的数目为![]() ,故
,故![]() 正确;
正确;
![]() 反应中
反应中![]() 中,只有Cl元素化合价发生变化,
中,只有Cl元素化合价发生变化,![]() 为氧化剂,HCl为还原剂,电子转移的方向和数目为:
为氧化剂,HCl为还原剂,电子转移的方向和数目为: ,当有
,当有![]() 生成时,转移5mol电子,71g氯气的物质的量为:
生成时,转移5mol电子,71g氯气的物质的量为:![]() ,则生成1mol氯气时转移的电子为:
,则生成1mol氯气时转移的电子为:![]() ,故
,故![]() 错误;
错误;
![]() 氨气的物质的量为:
氨气的物质的量为:![]() ,
,![]() 氨气分子中含有氮氢键的物质的量为:
氨气分子中含有氮氢键的物质的量为:![]() ,含
,含![]() 键数目为
键数目为![]() ,故
,故![]() 错误;
错误;
![]() 氧气的物质的量为1mol,过氧化钠中氧元素的化合价为
氧气的物质的量为1mol,过氧化钠中氧元素的化合价为![]() 价,则生成1mol氧气转移了2mol电子,即转移
价,则生成1mol氧气转移了2mol电子,即转移![]() 个电子,故
个电子,故![]() 正确;
正确;
![]() 在1L0.1mol·L-1的碳酸钠溶液中,含有溶质碳酸钠的物质的量为
在1L0.1mol·L-1的碳酸钠溶液中,含有溶质碳酸钠的物质的量为![]() ,由于碳酸根离子部分水解,则溶液中的
,由于碳酸根离子部分水解,则溶液中的![]() 总数小于
总数小于![]() ,故
,故![]() 错误;
错误;
根据分析可知,不正确的为![]() ,
,
故选D。


科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g,原混合气体中CO2的质量为( )
A.12.5gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
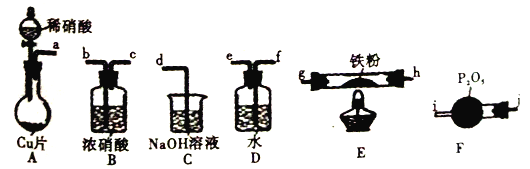
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(二元弱酸,分子式为H2C2O4)遍布于自然界,几乎所有的植物都含有草酸钙(CaC2O4)。
(1) 葡萄糖(C6H12O6)与HNO3反应可生成草酸和NO,其化学方程式为________。
(2) 相当一部分肾结石的主要成分是CaC2O4。若某人每天排尿量为1.4 L,含0.10 g Ca2+。当尿液中c(C2O42-)>________mol·L-1时,易形成CaC2O4沉淀。[已知Ksp(CaC2O4)=2.3×10-9]
(3) 测定某草酸晶体(H2C2O4·xH2O)组成的实验如下:
步骤1:准确称取0. 550 8 g邻苯二甲酸氢钾(结构简式为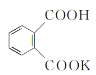 )于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.50 mL。
)于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.50 mL。
步骤2:准确称取0.151 2 g草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用步骤1中所用NaOH溶液滴定至终点(H2C2O4+2NaOH===Na2C2O4+2H2O),消耗NaOH溶液的体积为20.00 mL。
①“步骤1”的目的是____________________________________。
②计算x的值(写出计算过程)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为100的烷烃的分子式是____________________________。
(2)立方烷的结构简式为![]() ,其一氯代物有_____________种,它的六氯代物有__________________种。
,其一氯代物有_____________种,它的六氯代物有__________________种。
(3)下列物质的沸点按由高到低的顺序排列正确的是___________________。
①![]() ②
②![]() ③
③![]() ④
④![]()
A.②④①③ B.④②①③ C.④③②① D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以证明乙醇分子中羟基上的氢原子所处环境与其他氢原子明显不同的是( )
A.1mol乙醇完全燃烧生成3mol![]()
B.乙醇可以制饮料
C.1mol乙醇跟足量的![]() 作用得0.5mol
作用得0.5mol![]()
D.1mol 乙醇在催化剂作用下可与氧气反应生成1mol乙醛.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一种工业合成氨的简易流程图如图:
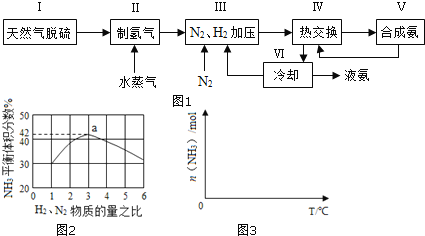
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com