
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
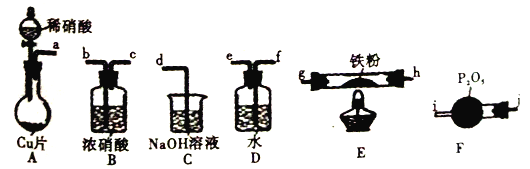
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
【答案】D
【解析】
A、根据实验原理利用NO被灼热的铁粉还原为N2,同时生成FeO,所以首先应制备纯净的干燥的NO,利用铜与稀硝酸反应生成NO,由于硝酸具有挥发性,所以制得的NO中会混有硝酸和水蒸气气体,则先通过装置D除去挥发出的HNO3等酸性气体,然后再通过F干燥,得到纯净的干燥的NO进入E中与铁粉反应,最后处理多余的NO,又因为NaOH溶液不与NO反应,而浓硝酸可氧化NO生成NO2,所以最终先通过B氧化NO,后再通过C吸收,故上述装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d,正确;B、装置E中NO被灼热的铁粉还原为N2,同时生成FeO,反应的化学方程式为2NO+2Fe![]() 2FeO+N2,正确;C、装置D盛放的是水,其作用是除去挥发出的HNO3等酸性气体,正确;D、装置B盛放的是浓硝酸,依题意可以氧化NO,便于氢氧化钠溶液吸收,错误。
2FeO+N2,正确;C、装置D盛放的是水,其作用是除去挥发出的HNO3等酸性气体,正确;D、装置B盛放的是浓硝酸,依题意可以氧化NO,便于氢氧化钠溶液吸收,错误。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 下列说法错误的是
下列说法错误的是![]()
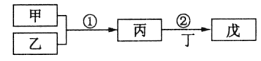
A.若戊为一种强碱且焰色反应为黄色,则反应![]() 可能都属于氧化还原反应
可能都属于氧化还原反应
B.常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸
C.若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲
D.若甲为浓盐酸,乙为![]() ,则戊可能使品红褪色
,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的水解离子方程式及沉淀溶解平衡方程式:
(1)NaClO水解离子方程式___________________________
(2)NH4Cl水解离子方程式____________________________
(3)KAl(SO4)2·12H2O水解离子方程式__________________________
(4)CaCO3沉淀溶解平衡方程式__________________________
(5)Fe(OH)3沉淀溶解平衡方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应,M(g)+N(g) ![]() R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应
R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应

A. 正反应是吸热反应,L是气体
B. 正反应是放热反应,L是气体
C. 正反应是吸热反应,L是固体
D. 正反应是放热反应,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
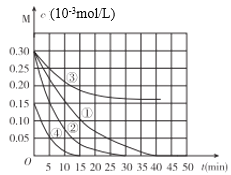
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢
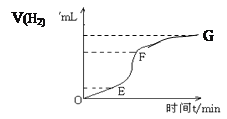
(1)用纯净的锌粒和盐酸反应制取氢气,回答:
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是___________________,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是________
A.胆矾晶体 B.硫酸氢钠固体
C.氯化锌浓溶液 D.浓硝酸
除了上述方法外,你认为还可以采取____________________措施来加快化学反应速率。
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。
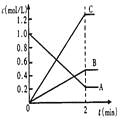
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为_________________。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为_____
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)_________
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是________________________________________
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是____________________________
(6)如图为石墨晶胞结构示意图,该晶胞中含有碳原子的个数为______
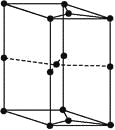
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com