
【题目】个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢
(1)用纯净的锌粒和盐酸反应制取氢气,回答:
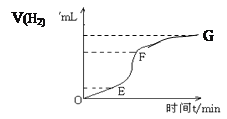
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是___________________,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是________
A.胆矾晶体 B.硫酸氢钠固体
C.氯化锌浓溶液 D.浓硝酸
除了上述方法外,你认为还可以采取____________________措施来加快化学反应速率。
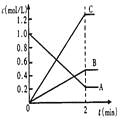
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为_______________
【答案】EF 反应放热,溶液温度升高,反应速率加快 EF AB 加热或把锌处理成小颗粒 2A![]() B+3C 0.4mol/(L·min)
B+3C 0.4mol/(L·min)
【解析】
(1)反应速率越快,则曲线的斜率越大,所以根据图像可知,EF段反应速率最快。这是由于反应放热,溶液温度升高,反应速率加快;根据纵坐标的变化可知,EF 段产生的氢气最多;胆矾溶于水,锌能置换出铜,从而构成铜锌原电池,加快反应速率,A正确;硫酸氢钠溶于水电离出氢离子,增大氢离子浓度,反应速率加快,B正确;氯化锌的浓溶液不能改变氢离子的浓度,反应速率变化不大,C错误;硝酸是氧化性酸,和锌反应得不到氢气,D不正确,答案选AB;由于温度和固体的表面积也可以改变反应速率,所以加热或把锌处理成小颗粒;施来加快化学反应速率。
(2)①根据图像可知,反应进行到2min时物质的浓度不再发生变化,反应达到平衡状态。其中A的浓度减少了0.8mol/L,B和C的浓度分别增加了0.4mol/L和1.2mol/L,则根据变化量之比是化学计量数之比可知,该反应的方程式是2A![]() B+3C。
B+3C。
②平衡时A的反应速率是0.8mol/L÷2min=0.4 mol/(L·min)。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
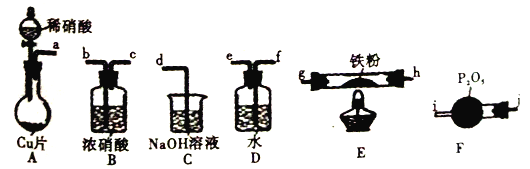
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入![]() 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、![]() 共存体系(不考虑氯气和水的反应)。下列说法正确的是
共存体系(不考虑氯气和水的反应)。下列说法正确的是
A.若反应中转移的电子为n mol,则![]()
B.溶液中![]() 可能为
可能为![]()
C.与NaOH反应的氯气物质的量:![]()
D.当溶液中![]() 时,反应的离子方程式为:
时,反应的离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1。
(1)Z的最外层电子轨道排布图为__;W元素的名称为__。
(2)XY2分子中X原子的杂化轨道类型为__;XO32-的空间构型为__。
(3)第一电离能X__Z(填“>”、“<”或“=”,下同);氢化物稳定性X__Y。
(4)配位化合物是中心金属原子或离子提供空轨道,配体提供孤电子对,以配位键结合而形成的一类化合物,中心原子或离子接受的鬼电子对数,称为配位数,则配位化合物[W(NH3)4(H2O)2]Cl2中,中心W2+的配位数为__;其结构中不含有的作用力有___。
A.极性键 B.非极性键 C.配位键 D.离子键
(5)金属Z的单质的晶胞结构如图:
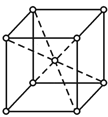
①区别晶体和非晶体的最科学的方法是__。
②上述金属晶体原子堆积模型为__型,其原子的空间利用率为__。
③若Z的摩尔质量为Mg/mol,密度为ρg/cm3,则Z的原子半径为___cm(列出算式即可)。
(6)已知:晶格能越大,离子晶体越稳定.则CaO、MgO、NaCl的稳定性由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制备并检验Cl2的性质,下列说法正确的是( )


A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B.Ⅱ图中:充分光照后,量筒中剩余气体约为10mL(条件相同)
C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,所得溶液呈蓝绿色
D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是植物秸秆的主要成分,以A为原料在一定条件下可获得多种有机物,它们的相互转化关系如图所示。已知F是一种最简单的烯烃。
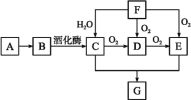
请回答:
(1)F→C的反应类型是___。
(2)B→C的化学方程式是___。
(3)下列说法正确的是___。
A.D能被氧化成E,但不能被还原成C
B.实验室制备G时可用浓硫酸作催化剂和吸水剂
C.B或E均能与银氨溶液反应形成银镜
D.相同质量的B、G完全燃烧生成水的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)![]() x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
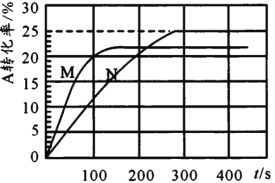
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com