
【题目】X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1。
(1)Z的最外层电子轨道排布图为__;W元素的名称为__。
(2)XY2分子中X原子的杂化轨道类型为__;XO32-的空间构型为__。
(3)第一电离能X__Z(填“>”、“<”或“=”,下同);氢化物稳定性X__Y。
(4)配位化合物是中心金属原子或离子提供空轨道,配体提供孤电子对,以配位键结合而形成的一类化合物,中心原子或离子接受的鬼电子对数,称为配位数,则配位化合物[W(NH3)4(H2O)2]Cl2中,中心W2+的配位数为__;其结构中不含有的作用力有___。
A.极性键 B.非极性键 C.配位键 D.离子键
(5)金属Z的单质的晶胞结构如图:
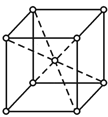
①区别晶体和非晶体的最科学的方法是__。
②上述金属晶体原子堆积模型为__型,其原子的空间利用率为__。
③若Z的摩尔质量为Mg/mol,密度为ρg/cm3,则Z的原子半径为___cm(列出算式即可)。
(6)已知:晶格能越大,离子晶体越稳定.则CaO、MgO、NaCl的稳定性由大到小的顺序为___。
【答案】![]() 镍 sp3 三角锥形 > < 6 B 对固体进行X-射线衍射实验 体心立方堆积 68%
镍 sp3 三角锥形 > < 6 B 对固体进行X-射线衍射实验 体心立方堆积 68% 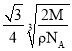 MgO>CaO>NaCl
MgO>CaO>NaCl
【解析】
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,则X为S,Y的原子序数比X大1,则Y为Cl,Z原子的M能层上有4个未成对电子,则Z为Fe,W的价层电子排布式为![]() ,则
,则![]() ,所以W为Ni。
,所以W为Ni。
(1)![]() 为Fe,Z的最外层电子轨道排布图为
为Fe,Z的最外层电子轨道排布图为![]() ,W为Ni,W元素的名称为镍,
,W为Ni,W元素的名称为镍,
故答案为:![]() ;镍;
;镍;
(2)![]() 分子中S原子的价层电子对数为
分子中S原子的价层电子对数为![]() ,所以S的杂化轨道类型为
,所以S的杂化轨道类型为![]() 杂化,
杂化,![]() 中硫原子的价层电子对数为
中硫原子的价层电子对数为![]() ,有一对孤电子对,所其空间构型为三角锥形,
,有一对孤电子对,所其空间构型为三角锥形,
故答案为:![]() ;三角锥形;
;三角锥形;
(3)元素非金属性越强,第一电离能越大,所以S的第一电离能![]() 的第一电离能,元素非金属性越强,气态氢化物越稳定,所以氢化物稳定性
的第一电离能,元素非金属性越强,气态氢化物越稳定,所以氢化物稳定性![]() ,
,
故答案为:![]() ;
;![]() ;
;
(4)根据配位化合物![]() 的组成可知,中心
的组成可知,中心![]() 的配位数为6;其结构中不含非极性键,故选B,
的配位数为6;其结构中不含非极性键,故选B,
故答案为:6;B;
(5)①区别晶体和非晶体的最科学的方法是对固体进行![]() 射线衍射实验,
射线衍射实验,
故答案为:对固体进行![]() 射线衍射实验;
射线衍射实验;
②根据Fe的晶胞结构可知,Fe晶体原子堆积模型为体心立方堆积,体心立方中含有铁原子数为![]() ;设铁原子半径为r,晶胞中铁原子的体积为:
;设铁原子半径为r,晶胞中铁原子的体积为:![]() ;体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:
;体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:![]() ,空间利用率为:
,空间利用率为: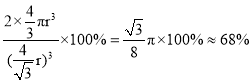 ,
,
故答案为:体心立方堆积;![]() ;
;
③设铁原子半径为r,根据![]() 中分析可知中,晶胞边长为:
中分析可知中,晶胞边长为:![]() ,晶胞中含有铁原子数为
,晶胞中含有铁原子数为![]() ,根据
,根据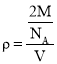 可知,
可知,![]() ,所以
,所以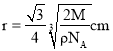 ,
,
故答案为: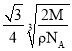 ;
;
(6)由于钙离子的半径大于镁离子,氧化钙中离子所带电荷大于氯化钠,所以晶格能大小顺序为![]() ,所以CaO、MgO、NaCl的稳定性由大到小的顺序为
,所以CaO、MgO、NaCl的稳定性由大到小的顺序为![]() ,
,
故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
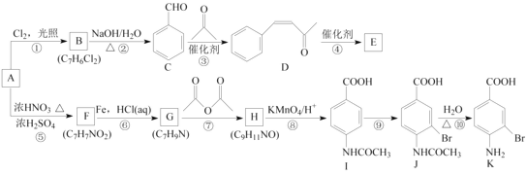
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
己知:①![]() ;
;
②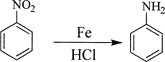
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
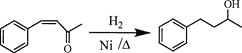 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
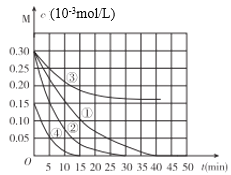
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
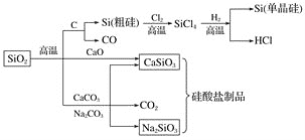
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢
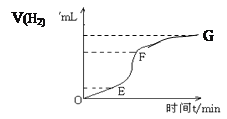
(1)用纯净的锌粒和盐酸反应制取氢气,回答:
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是___________________,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是________
A.胆矾晶体 B.硫酸氢钠固体
C.氯化锌浓溶液 D.浓硝酸
除了上述方法外,你认为还可以采取____________________措施来加快化学反应速率。
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。
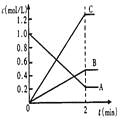
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于固定体积的密闭容器中进行的反应:A(g)+B(g)![]() C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
①反应容器中压强不随时间变化而变化
②单位时间内生成A的物质的量与消耗D的物质的量之比为1:2
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化
A. ②④ B. ③④ C. ①③ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知ROH固体溶于水放热,有关过程的能量变化如图(R=Na、K):
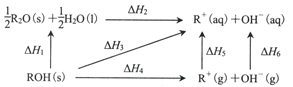
下列说法正确的是
A.△H1+△H2>0B.△H4(NaOH)>△H4(KOH)>0
C.△H6(NaOH>△H6(KOH)D.△H1+△H2+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R 均是 1-18 号元素,原子序数依次增大。X 是所有元素中原子半径最小的元素,Y 原子最外层电子数是次外层电子数的 3 倍,Z、W、R 电子层数相同,R 与 Y 最外层电子数相同,Z、W 原子的核外电子数之和与 Y、R 原子的核外电子数之和相同。请回答下列问题:
(1)写出:W 的原子结构示意图_______,R 离子的电子式_________________。
(2)X、Y、Z 三种元素形成的化合物属于_______化合物(填“离子”或“共价”),其电子式为 _______。
(3)X 与 Y 元素可形成一种常用的消毒剂,其结构式为 _______。
(4)Y、Z、W、R 形成的简单离子半径由大到小顺序为_______。
(5)写出由 X、Y、Z、R 四种元素形成的化合物的电离方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com