
【题目】己知ROH固体溶于水放热,有关过程的能量变化如图(R=Na、K):
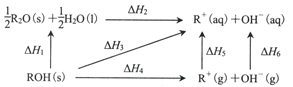
下列说法正确的是
A.△H1+△H2>0B.△H4(NaOH)>△H4(KOH)>0
C.△H6(NaOH>△H6(KOH)D.△H1+△H2+△H4+△H5+△H6=0
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】实验室制备NaI的装置如图所示,基本步骤为:![]() 检查装置气密性;
检查装置气密性;![]() 关闭K,向B中滴入
关闭K,向B中滴入![]() 溶液,制得
溶液,制得![]() ;
;![]() 打开K,通入
打开K,通入![]() 至饱和制得NaI,同时有黄色沉淀产生;
至饱和制得NaI,同时有黄色沉淀产生;![]() 关闭K,向所得溶液加入稀硫酸,水浴加热,充分逸出
关闭K,向所得溶液加入稀硫酸,水浴加热,充分逸出![]() ;
;![]() 把B中混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。下列有关叙述错误的是
把B中混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。下列有关叙述错误的是
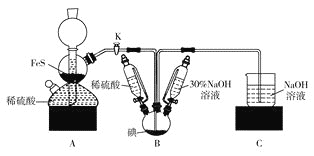
A.A中装置可随开随用、随关随停,制备气体原理为:![]()
B.制备NaI涉及以下两个反应:![]() 、
、![]()
C.装置B中的恒压分液漏斗可以平衡分液漏斗和三口烧瓶内压强,便于液体顺利流下
D.步骤![]() 中的“一系列操作”包括过滤、洗涤、合并滤液和洗液、蒸馏等操作
中的“一系列操作”包括过滤、洗涤、合并滤液和洗液、蒸馏等操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1。
(1)Z的最外层电子轨道排布图为__;W元素的名称为__。
(2)XY2分子中X原子的杂化轨道类型为__;XO32-的空间构型为__。
(3)第一电离能X__Z(填“>”、“<”或“=”,下同);氢化物稳定性X__Y。
(4)配位化合物是中心金属原子或离子提供空轨道,配体提供孤电子对,以配位键结合而形成的一类化合物,中心原子或离子接受的鬼电子对数,称为配位数,则配位化合物[W(NH3)4(H2O)2]Cl2中,中心W2+的配位数为__;其结构中不含有的作用力有___。
A.极性键 B.非极性键 C.配位键 D.离子键
(5)金属Z的单质的晶胞结构如图:
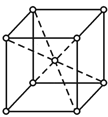
①区别晶体和非晶体的最科学的方法是__。
②上述金属晶体原子堆积模型为__型,其原子的空间利用率为__。
③若Z的摩尔质量为Mg/mol,密度为ρg/cm3,则Z的原子半径为___cm(列出算式即可)。
(6)已知:晶格能越大,离子晶体越稳定.则CaO、MgO、NaCl的稳定性由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将已加热至恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
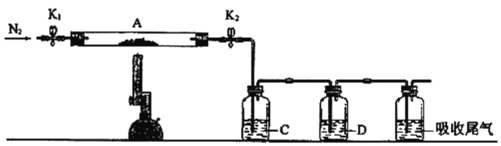
①C、D中的溶液依次为___、___(填标号)。C、D中有气泡冒出,并可观察到的现象分别为___。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是植物秸秆的主要成分,以A为原料在一定条件下可获得多种有机物,它们的相互转化关系如图所示。已知F是一种最简单的烯烃。
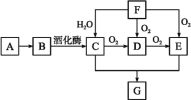
请回答:
(1)F→C的反应类型是___。
(2)B→C的化学方程式是___。
(3)下列说法正确的是___。
A.D能被氧化成E,但不能被还原成C
B.实验室制备G时可用浓硫酸作催化剂和吸水剂
C.B或E均能与银氨溶液反应形成银镜
D.相同质量的B、G完全燃烧生成水的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是
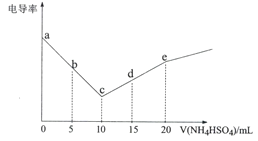
A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上绝大部分卤素都存在于海洋。海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出电解饱和食盐水的离子方程式_______。若转移 5mol 电子,生成氯气_______L(标准状况下)。
溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为:
①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2
②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3、CO2
③用硫酸酸化步骤②得到的混合物
(2)先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是 _______。
(3)写出步骤②化学方程式 _______。
(4)写出步骤③所发生的化学反应方程式并标出电子转移的方向和数目_______。
(5)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物数量众多,分布极广,与人类关系非常密切。
(1)石油裂解得到某烃A,其球棍模型为![]() ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_________,A的名称是____________。
②A与溴的四氯化碳溶液反应的化学方程式为_______________。

③A→C的反应类型是____,C+D→E的化学方程式为_______,鉴别C和D的方法是_______。
④A的同系物B的相对分子质量比A大14,B的结构有____种。
(2)生苹果肉遇碘酒变蓝,熟苹果汁能与银氨溶液反应,苹果由生到成熟时发生的相关反应方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com