
【题目】氢气是一种清洁能源。可由CO和水蒸气反应制备,其能量变化如图所示。
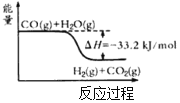
(1)该反应为可逆反应。在800℃时,若CO的起始浓度为2.0mol·L-1,水蒸气的起始浓度为3.0mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2mol·L-1,则此反应的平衡常数为___,随着温度升高该反应的化学平衡常数的变化趋势是___。(填“变大”、“变小”或“不变”)
(2)某温度下,该反应的平衡常数为K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是(________)
。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是(________)
起始浓度 | 甲 | 乙 | 丙 |
c(H2O)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol·L-1
D.平衡时,乙中H2O的转化率大于25%
(3)一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,达到平衡后:
2NH3(g) ΔH<0,达到平衡后:
①加催化剂,v(正)、v(逆)都发生变化,且变化的倍数___(填“相等”或“不相等”)。
② 缩小体积使体系压强增大,则v(正)__,v(逆)__(填“增大”、“减小”或“不变”),v(正)变化的倍数___v(逆)变化的倍数(填“大于”、“小于”或“等于”)。
③恒温恒压,再通入一定量的He,达到新平衡时,N2的转化率__,c(H2)将__(填“增大”、“减小”或“不变”)。
【答案】1 变小 CD 相等 增大 增大 大于 减小 减小
【解析】
(1)根据三段式计算化学平衡常数K,该反应的正反应是放热反应,升高温度平衡逆向移动;
(2)A.反应开始时,反应物浓度越大,反应速率越大;B.该反应前后气体计量数之和不变,增大压强,平衡不移动,根据三段式,结合化学平衡常数K=![]() 计算判断;C.该反应前后气体计量数之和不变,增大压强,平衡不移动;D.乙与甲相比较,相当于在甲的基础上通入H2O;据此分析判断;
计算判断;C.该反应前后气体计量数之和不变,增大压强,平衡不移动;D.乙与甲相比较,相当于在甲的基础上通入H2O;据此分析判断;
(3)①催化剂能同等程度的改变正逆反应速率;②缩小体积使体系压强增大,v(正)、v(逆)都增大,平衡正向移动;③恒温恒压,再通入一定量的He,容器体积增大,相当于压强减小,据此分析解答。
(1) CO(g)+H2O(g)CO2(g)+H2(g)
开始(mol/L) 2.0 3.0 00
反应(mol/L) 1.2 1.2 1.2 1.2
平衡(mol/L) 0.8 1.8 1.2 1.2
化学平衡常数K=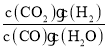 =
=![]() =1,该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,故答案为:1;变小;
=1,该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,故答案为:1;变小;
(2)A.反应开始时,反应物浓度越大,其反应速率越大,丙中反应物浓度最大、甲中反应物浓度最小,则化学反应速率丙中最快、甲中最慢,故A正确;
B.该反应前后气体计量数之和不变,增大压强平衡不移动,设甲中参加反应的c(H2O)=xmol/L,
CO(g) + H2O(g)CO2(g)+H2(g)
开始(mol/L) 0.010 0.010 0 0
反应(mol/L) x x x x
平衡(mol/L) 0.010-x 0.010-x x x
化学平衡常数K=![]() =
=![]() ,x=0.0025,水的转化率=
,x=0.0025,水的转化率=![]() ×100%=25%,丙与甲相比,相当于甲缩小体积变为原来体积的一半,增大压强,平衡不移动,则甲丙中水的转化率相等,均为25%,故B正确;
×100%=25%,丙与甲相比,相当于甲缩小体积变为原来体积的一半,增大压强,平衡不移动,则甲丙中水的转化率相等,均为25%,故B正确;
C.丙与甲相比,相当于甲缩小体积变为原来体积的一半,增大压强,平衡不移动,平衡时,丙中c(CO2)是甲中的2倍,为0.0025mol/L×2=0.005mol/L,故C错误;
D.乙与甲相比较,相当于在甲的基础上通入H2O,则水的转化率下降,平衡时,乙中的水的转化率小于25%,故D错误;
故答案为:CD;
(3)①催化剂能同等程度的改变正、逆反应速率,加催化剂,则v(正)、v(逆)都发生变化,且变化的倍数相等,故答案为:相等;
②缩小体积使体系压强增大,单位体积内活化分子个数增大,v(正)、v(逆) 都增大,但平衡正向移动,v(正)变化的倍数大于v(逆)变化的倍数,故答案为:增大;增大;大于;
③恒温恒压,再通入一定量的He,容器的体积增大,相当于反应体系的压强减小,平衡逆向移动,达到新平衡时,N2的转化率减小,c(H2)将减小,故答案为:减小;减小。


科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值.下列叙述正确的是
表示阿伏加德罗常数的值.下列叙述正确的是
A.![]() 与足量
与足量![]() 反应,共生成
反应,共生成![]() ,转移电子的数目为
,转移电子的数目为![]()
B.室温下,![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 离子数目为
离子数目为![]()
C.![]() 聚丙烯中含有双键的数目为
聚丙烯中含有双键的数目为![]()
D.含![]() 的饱和溶液最多可形成胶体粒子数为
的饱和溶液最多可形成胶体粒子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CH3OH的摩尔质量是__gmol-1。
(2)2molH2O中所含原子的物质的量为__mol。
(3)__g的氢气中所含H原子的数目与1molCH3OH相同。
(4)含0.1NA个O的CO2中有__个电子,标况下该CO2的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
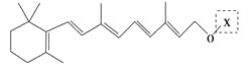
为了研究X的结构,将化合物A在一定条件下水解只得到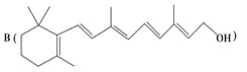 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。
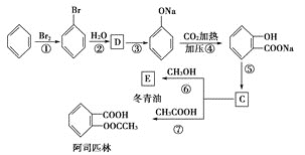
(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置(省略夹持装置及加热装置)可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是 ( )
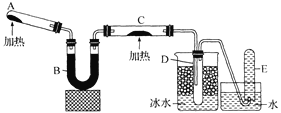
A.试管A中加入的试剂为NH4Cl固体
B.反应中氧化剂和还原剂的物质的量之比为2 : 3
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.装置D中液体可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是
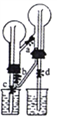
A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com