
【题目】(1)已知氨气的化学式是NH3,其摩尔质量为____;6.8g NH3的物质的量为___mol,其标准状况下的体积为___L,其含NH3分子的个数为___,含有氢原子的个数为_____。
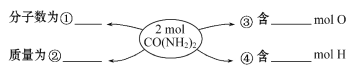
(2)在①、②、③、④处的横线上填上适当的内容。______、__________、______、__________
(3)12.4 g Na2R含0.4 mol Na+,则Na2R的摩尔质量为________。
【答案】17g/mol 0.4mol 8.96 2.408×1023(0.4NA) 7.224×1023(1.2NA) 2NA或1.204×1024 120 g 2 8 62 g·mol-1
【解析】
(1)N的相对原子质量为14,H的相对原子质量为1,所以NH3摩尔质量为17g/mol;6.8g NH3的物质的量为![]() ;标况下的体积为0.4mol×22.4L/mol=8.96L;含NH3分子的个数为2.408×1023(或0.4NA),含氢原子物质的量为0.4mol×3=1.2mol,所以个数为7.224×1023(或1.2NA);
;标况下的体积为0.4mol×22.4L/mol=8.96L;含NH3分子的个数为2.408×1023(或0.4NA),含氢原子物质的量为0.4mol×3=1.2mol,所以个数为7.224×1023(或1.2NA);
(2)2molCO(NH2)2的分子数为2 NA或1.204×1024;其质量为2mol×60g/mol=120 g;含2molO,8molH;
(3)12.4 g Na2R含0.4 mol Na+,则其物质的量为0.2mol,所以其摩尔质量为![]() 。
。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)_______0.2 mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_____mol/L;
c(H+)-c(MOH)=__________mol/L
⑵常温下若将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度______NaA的水解程度。(填“>”、“<”、或“=”)
⑶已知:难溶电解质Cu(OH)2在常温下的Ksp = 2×1020,则常温下:某CuSO4溶液中c(Cu2+) = 0.02 mol·L1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为_________。
⑷已知:温度和浓度相等时,氨水的电离程度与醋酸相等。常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列___________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子原理,O3分子的空间构型为________。
(3)氯与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为____________________。

(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=______________________(填数值);氢在合金中的密度为________(保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
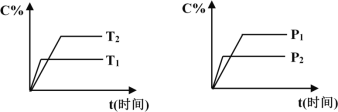
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油是化工原料的重要来源,从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂。从煤焦油中可获得烃B,B中碳、氢两种元素的质量比为12:1,且B是常见的有机溶剂。工业上可以通过以下途径获得A、B。
![]()
![]()
(1)由煤得到煤焦油的方法称为________;由石蜡油获得A的方法称为________。
(2)A和B中,能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”)。
(3)写出B发生取代反应的化学方程式:________________________(写一个即可,并注明反应条件)。
(4)用B和丙烯可以生产两种重要的化工原料:苯酚(![]() )和丙酮(
)和丙酮(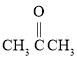 ),生产流程如下:
),生产流程如下:
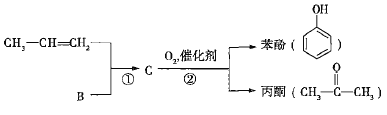
已知反应①是加成反应,C的一氯代物有5种,则C的结构简式为_____________;反应②的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气体有机物A是一种重要的化工原料,其在标准状况下的密度为![]() 。已知乙烯与乙酸在一定条件下能发生反应生成乙酸乙酯。
。已知乙烯与乙酸在一定条件下能发生反应生成乙酸乙酯。
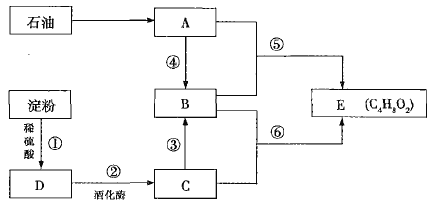
(1)C中的官能团名称是________;⑥的反应类型是________。
(2)反应⑤的化学反应方程式为___________________________________________(反应条件忽略)。
(3)下列说法正确的是________(填序号)。
A.淀粉发生反应①后直接加入银氨溶液可以检验D的生成
B.B、C、E可以用饱和碳酸钠溶液鉴别
C.反应⑥中浓硫酸的作用是催化剂和吸水剂
D.①和④的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-△H>0,下列叙述正确的是( )
H++OH-△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体亚硫酸氢钠,c(H+)增大,水的电离程度增大
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)请写出装有铜网的试管中反应的化学方程式:___。
(2)不断鼓入空气,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是____反应(填“吸热”或“放热”)。
(3)甲和乙两个水浴作用不相同。甲的作用是___;乙的作用是___。
(4)反应进行一段时间后,集气瓶收集到的气体主要是___。
(5)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,要除去该物质,选择的试剂是__(填写字母):
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.金属钠
再通过___(填实验操作名称)即可得到乙醛。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com