
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-△H>0,下列叙述正确的是( )
H++OH-△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体亚硫酸氢钠,c(H+)增大,水的电离程度增大
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH减小
【答案】D
【解析】
A. 向水中加入氨水,溶液由中性到碱性,碱对水的电离起抑制作用,所以平衡逆向移动,但c(OH-)增大,故A错误;
B. NaHSO3在溶液中电离大于水解,电离出的氢离子使溶液中c(H+)增大,溶液呈酸性,H+使水的电离平衡向右移动,水的电离程度减小,故B错误;
C. 在25℃时水的离子积常数是1×10-14,某溶液中由水电离出的c(H+)=1×10-12mol/L,水的电离受到了抑制,可能是外加酸,也可能是外加碱,若外加酸,则溶液中c(H+)=1×10-14÷1×10-12=1×10-2mol/L,pH=2;若外加碱,则c(H+)=1×10-12mol/L,pH=12,故C错误;
D. 水的电离是吸热过程,加热后平衡向电离方向移动,H+与OH-的浓度增大,水的离子积常数Kw增大,溶液中PH减小,故D正确;
故选D。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
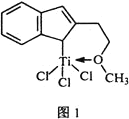
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
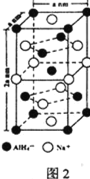
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知氨气的化学式是NH3,其摩尔质量为____;6.8g NH3的物质的量为___mol,其标准状况下的体积为___L,其含NH3分子的个数为___,含有氢原子的个数为_____。
(2)在①、②、③、④处的横线上填上适当的内容。______、__________、______、__________
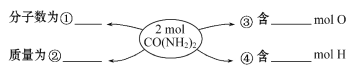
(3)12.4 g Na2R含0.4 mol Na+,则Na2R的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(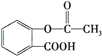 )是常用的解热镇痛药,下列说法不正确的是( )
)是常用的解热镇痛药,下列说法不正确的是( )
A.1mol阿司匹林可以与3molNaOH反应
B.阿司匹林与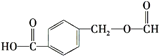 互为同分异构体
互为同分异构体
C.阿司匹林可以发生取代反应、加成反应、酯化反应
D.1mol阿司匹林可以与5molH2发生加成反应,也可与1mol碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的反应X+3Y![]() 2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
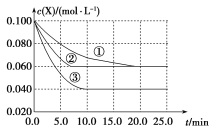
A.反应0~5.0min实验③的反应速率最快B.条件②的反应最先达到平衡
C.②与①比较,②可能压强更大D.该反应的正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值![]() 表示
表示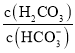 或
或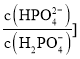 与pH的关系如图所示。已知碳酸
与pH的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]()
![]() 。则下列说法不正确的是( )
。则下列说法不正确的是( )
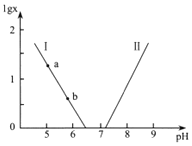
A.曲线Ⅱ表示 与pH的变化关系
与pH的变化关系
B.![]() 的过程中,水的电离程度逐渐增大
的过程中,水的电离程度逐渐增大
C.当![]()
![]() 时,
时,![]()
D.当pH增大时,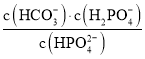 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有关反应的能量变化如图,试回答下列问题。
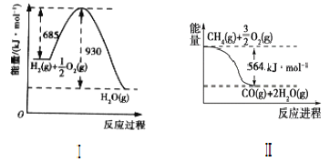
(1)根据图像,写出Ⅰ的热化学方程式:____。
(2)写出CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:____。
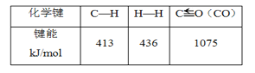
(3)在(2)的反应中,相关的化学键键能数据如下表所示。判断H2O(g)中O—H的键能为___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①C(s)+CO2(g)=2CO(g)△H1,C(s)+![]() O2(g)=CO(g)△H2则△H1___△H2。
O2(g)=CO(g)△H2则△H1___△H2。
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H3,CH4(g)+H2O(l)=CO(g)+3H2(g)△H4,则△H3___△H4
③2H2(g)+O2(g)=2H2O(1)△H4,2H2(g)+O2(g)=2H2O(g)△H5,则△H4___△H5。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)从下列物质中选择对应类型的物质的序号填空。
①CH3OCH3②HCOOCH2CH3③CH3COCH3④![]() ⑤CH3CHO⑥
⑤CH3CHO⑥![]() ⑦
⑦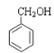
A.属于酯的是__;(填序号,下同)
B.属于酮的是__;
(2)下列各组物质:
①O2和O3;②乙醇和甲醚;③淀粉和纤维素;④苯和甲苯;⑤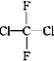 和
和![]()
![]() ;⑥
;⑥ 和
和![]() ;⑦CH3CH2NO2和
;⑦CH3CH2NO2和![]()
A.互为同系物的是__;(填序号,下同)
B.属于同一种物质的是__。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68LCO2和7.2gH2O;
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是__,有机物A的分子式为__。
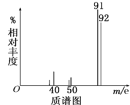
③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗称草酸![]() 结构简式为
结构简式为![]() ,可简写为
,可简写为![]() ,它是一种重要的化工原料.
,它是一种重要的化工原料.![]() 常温下
常温下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 写出
写出![]() 的电离方程式______.
的电离方程式______.
![]() 溶液显酸性的原因是______;向
溶液显酸性的原因是______;向![]() 的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.![]()
![]()
![]()
![]()
![]() 与酸性高锰酸钾溶液反应,现象是有气泡
与酸性高锰酸钾溶液反应,现象是有气泡![]() 产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
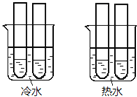
![]() 某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL
某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
![]() 已知草酸
已知草酸![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() ,写出
,写出![]() 在密闭容器中高温分解的化学方程式______.
在密闭容器中高温分解的化学方程式______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com