
【题目】某电池总反应为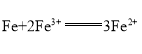 ,下列与此电池总反应不符的原电池是( )
,下列与此电池总反应不符的原电池是( )
A.铜片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
B.石墨、铁片、![]() 溶液组成的原电池
溶液组成的原电池
C.铁片、锌片、![]() 溶液组成的原电池
溶液组成的原电池
D.银片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
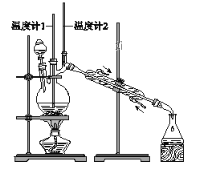
利用下图装置用正丁醇合成正丁醛。相关数据如下:
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
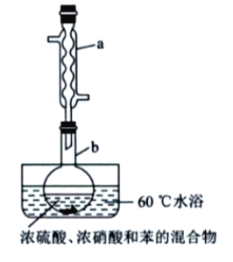
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
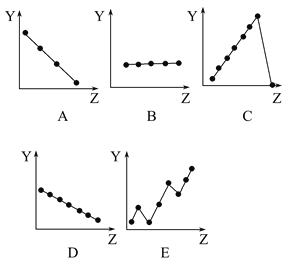
把与元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素原子的价电子数___________;
(2)第三周期元素的最高正化合价___________;
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___________;
(4)第二周期元素的原子半径(不包括稀有气体) ___________;
(5)第二周期元素的第一电离能 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是![]() 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl |
|
| HClO |
|
|
|
|
|
|
|
A.相同浓度![]() 和
和![]() 的混合液中,各离子浓度的大小关系是
的混合液中,各离子浓度的大小关系是![]()
B.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
C.向![]() HClO溶液中滴加NaOH溶液至
HClO溶液中滴加NaOH溶液至![]() :
:![]() 1:3,此时溶液
1:3,此时溶液![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀
先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO![]()
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO![]() 、SO
、SO![]()
C.含有Ca2+的溶液中:Na+、K+、CO![]() 、Cl-
、Cl-
D.水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.化学平衡发生移动,平衡常数一定发生变化
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
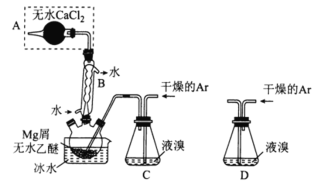
主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
⑴仪器A的名称是___________。B的作用为___________。
⑵下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
⑶若将装置C改为装置D,可能会导致的后果是___________。
⑷为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是_______________(用质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com