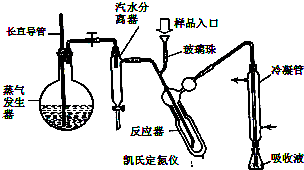
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
已知:2NH
3+4H
3BO
3→(NH
4)
2B
4O
7+5H
2O
(NH
4)
2B
4O
7+2HCl+5H
2O→2NH
4Cl+4H
3BO
3实验步骤
1.称取婴幼儿奶粉2.000g,移入干燥的消化管中,加入0.2g硫酸铜、3g硫酸钾及20mL硫酸,充分加热冷却后移入100mL容量瓶中,用水定容至100mL(消化液).
2.碱化蒸馏
在锥形瓶中加入10mL2%硼酸、2滴混合指示剂,并吸取10.0mL样品消化液从样品入口注入凯氏定氮仪.用10mL蒸馏水冲洗样品入口,再加10mL50%氢氧化钠溶液,打开水蒸汽发生器与反应器之间的夹子,蒸汽通入反应器使氨气全部被蒸发出来,并通过冷凝管而进入锥形瓶内.加热蒸气发生器5min,取下锥形瓶.
3.滴定
用酸式滴定管,以0.0500mol/L盐酸标准溶液进行滴定至终点.重复上述实验三次,所用盐酸平均体积为5.00mL.试回答下列问题
(1)加入K
2SO
4是为了升高溶液的沸点,加入CuSO
4作用可能是:
.
(2)蒸气发生器中长直导管的作用是:
.
(3)如何确定氨全部被水蒸出并进入锥形瓶:
.
(4)本次测定中,该奶粉中蛋白质的质量分数为:
.
(5)奶粉含下列杂质或实验操作中,会使计算结果中蛋白质含量值“增加”的是
.
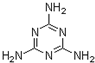
A.含三聚氰胺(
) B.样品入口未用蒸馏水冲洗
C.定容消化液时俯视刻度线 D.滴定开始时仰视读数,滴定终点时俯视读数.

 蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量. ) B.样品入口未用蒸馏水冲洗
) B.样品入口未用蒸馏水冲洗 )含氮量高,会使计算结果中蛋白质含量值“增加”;
)含氮量高,会使计算结果中蛋白质含量值“增加”;


 →RCHO+H2O
→RCHO+H2O ,经过的反应是
,经过的反应是

 和C2H4
和C2H4