


| ||
| 2 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| 催化剂 |
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀层未破损的镀锌铁和镀层破损后的镀锌铁分别与盐酸反应时产生H2的速度相同 |
| B、用50mL酸式滴定管可准确量取25.00mL的Na2CO3溶液 |
| C、往新配制的淀粉溶液中滴加碘水,溶液显蓝色,加入足量NaOH后溶液褪色 |
| D、配制稀H2SO4溶液时,先在量筒中加入一定体积的水,再在不断搅拌下慢慢加浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH
某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
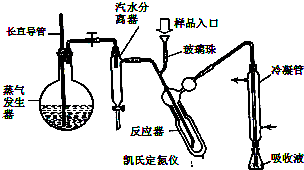 蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.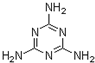 ) B.样品入口未用蒸馏水冲洗
) B.样品入口未用蒸馏水冲洗查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
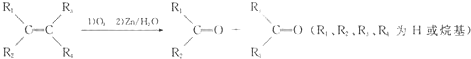
| A、(CH3)2═C(CH3)2 |
| B、2-氯-2-丁烯 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)<c(OH-)<c(A-)<c(B+) |
| B、c(OH-)<c(H+)<c(B+)<c(A-) |
| C、c(A-)=c(B+)>c(H+)=c(OH-) |
| D、c(A-)=c(B+)<c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com