
 某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH
某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH| 浓硫酸 |
| △ |
 ,A在浓硫酸作用下生成CH2=CH2,故A为CH3CH2OH,CH2=CH2和HBr发生加成反应生成C为CH3CH2Br,据此答题;
,A在浓硫酸作用下生成CH2=CH2,故A为CH3CH2OH,CH2=CH2和HBr发生加成反应生成C为CH3CH2Br,据此答题; ,A在浓硫酸作用下生成CH2=CH2,故A为CH3CH2OH,CH2=CH2和HBr发生加成反应生成C为CH3CH2Br,
,A在浓硫酸作用下生成CH2=CH2,故A为CH3CH2OH,CH2=CH2和HBr发生加成反应生成C为CH3CH2Br,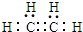 ,
,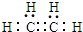 ;
;| 浓硫酸 |
| △ |
| 催化剂 |
 ,反应的方程式为
,反应的方程式为 ,
,| 浓硫酸 |
| △ |
| 催化剂 |
 ;加聚反应;
;加聚反应;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、(2)(5) |
| B、(5)(6) |
| C、(1)(3) |
| D、(2)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑧ | B、②⑤⑧ |
| C、④⑤⑧ | D、③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
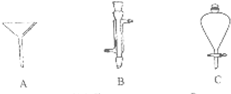 Ⅰ、如图是几种实验中常用的仪器:写出序号所代表的仪器的名称:
Ⅰ、如图是几种实验中常用的仪器:写出序号所代表的仪器的名称:查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H6 |
| ②H2O2/OH- |
 →RCHO+H2O
→RCHO+H2O ,经过的反应是
,经过的反应是查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A、某溶液
| ||
B、某溶液
| ||
C、某溶液
| ||
D、某溶液
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com