
����Ŀ����ѧԭ������ѧ��ѧѧϰ����Ҫ���ݡ���ش��������⣺
��1���ټ�֪��CH4��H2��ȼ���ȣ���H���ֱ�Ϊ��890.3kJ/mol����285.8kJ/mol����CO2��H2��Ӧ����CH4���Ȼ�ѧ����ʽ��__________________________��
������������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ��ʾ����������ĵ缫��Ӧʽ��________��A��____��

��2���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ�Ͽ��úϳ����Ʊ��״�����ӦΪCO��g��+2H2��g��![]() CH3OH��g����ij�¶������ݻ�Ϊ2L���ܱ������н��и÷�Ӧ����������ݼ�ͼ��
CH3OH��g����ij�¶������ݻ�Ϊ2L���ܱ������н��и÷�Ӧ����������ݼ�ͼ��

�ٴӷ�Ӧ��ʼ��ƽ��ʱ����CO��ʾ��ѧ��Ӧ����Ϊ________�����¶��µ�ƽ�ⳣ��Ϊ__��
��5min��10minʱ���ʱ仯��ԭ�������__________________��
��3���ٳ����£���V mL��0.1000mol/L����������Һ��μ��뵽20.00mL��0.1000mol/L������Һ�У���ַ�Ӧ��������Һ����ı仯���������ҺpH=7����ʱV��ȡֵ___20.00�����������=������������Һ��c��Na+����c��CH3COO������c��H+����c��OH�����Ĵ�С��ϵ��_____________________��
�ڳ����£���a mol/L�Ĵ�����b mol/L������������Һ�������ϣ���Ӧ����Һ�����ԣ������ĵ��볣��Ϊ_______���ú���a��b��ĸ�Ĵ���ʽ��ʾ����
���𰸡�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=��252.9 kJ/mol N2+8H++6e��=2NH4+ �Ȼ�� 0.03mol/��Lmin�� 75/8 ��Ӧ���Ȼ�ʹ���˴��� �� c��Na+��=c��CH3COO������c��H+��=c��OH���� 10��7b/(a-b)
��������
��1���ٷֱ�д��CH4��H2��ȼ���ȵ��Ȼ�ѧ����ʽ�����ݸ�˹���ɽ��м����H��
�ڵ��������ʧ����,�ڸ�������������Ӧ,�����õ���������������ԭ��Ӧ,������HCl��Ӧ�����Ȼ��,��������ҺΪ�Ȼ����
��2����10minʱ��Ӧ����ƽ����ƽ��ʱCOΪ0.4mol���״�Ϊ0.6mol������Ϊ0.8mol������v=c/t����v(CO)������K=c(CH3OH)/c(CO)��c2(H2)����ƽ�ⳣ����
�ڷ�Ӧ�������С��������������࣬���ʼӿ죬�ı���������������»���������
��3������Һ��������Ǹ�����Һ��������Ũ��������������Ũ�ȵ���Դ�С�жϵ�,ֻҪ��Һ��c��H+��=c��OH��������Һ�ͳ��������������������������̶Ȳ�����NaOH��ǿ���������ȫ��������Ӧ���ɵ���������ǿ��������ˮ��ʼ���,����Һ������,���ټӼ���������Һ������c��H+��=c��OH����������ϵ���غ���н����
�ڳ�������c��H+��=c��OH����=10-7mol/L��c��Na+��=c��CH3COO����=bmol/L���ݴ˽���ƽ�ⳣ���ļ��㡣
��1���ټ����ȼ����Ϊ890.3kJ/mol���Ȼ�ѧ����ʽ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��890.3 kJ/mol��H2��ȼ����Ϊ285.8kJ/mol���Ȼ�ѧ����ʽΪ��H2(g)+1/2O2(g)=H2O(l)����H=��285.8kJ/mol�����ݸ�˹���ɿ�֪������4-���ɵ���CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=-285.8��4+890.3=��252.9 kJ/mol������CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=��252.9 kJ/mol������������������ǣ�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=��252.9 kJ/mol��
�ڸõ�صı��ʷ�Ӧ�Ǻϳɰ���Ӧ,���������ʧ����,�ڸ�������������Ӧ,�����õ���������������ԭ��Ӧ,��������ӦʽΪ��N2+8H++6e��=2NH4+��������HCl��Ӧ�����Ȼ������������ҺΪ�Ȼ����Һ��
��ˣ�������ȷ����: N2+8H++6e��=2NH4+���Ȼ����
(2)��10minʱ��Ӧ����ƽ��,ƽ��ʱCOΪ0.4mol���״�Ϊ0.6mol������Ϊ0.8mol,��v(CO)=(1-0.4)/(2��10)=0.03mol/��Lmin����ƽ�ⳣ��K=c(CH3OH)/c(CO)��c2(H2)= (0.6/2)/[0.4/2��(0.8/2)2]=75/8��
��ˣ�������ȷ������0.03mol/��Lmin���� 75/8��
��5minʱ��˲�����ֵ����ʵ���δ��������Ӧ���ʼӿ�,��Ӧ�����������С���������������������������ʹ���˴������������¶���
��ˣ�������ȷ����: ��Ӧ���Ȼ�ʹ���˴�����
��3���ٴ������������������̶Ȳ�����NaOH��ǿ���������ȫ����,��Ӧ���ɵ���������ǿ����������ˮ��ʼ����������Һ������pH=7�����ټӼ������Գ�����, ��V mL��0.1000mol/L����������Һ��μ��뵽20.00mL��0.1000mol/L������Һ�У���ַ�Ӧ����ʱV��ȡֵС��20.00 mL����Һ�����ԣ�c��H+��=c��OH���������ݵ���غ���c(Na+)+ c(H+)= c(CH3COO��)+ c(OH��)������c��Na+��=c��CH3COO������������Һ�е�����Ϊ��������Һ��ˮ�ĵ���������,������Һ��c��Na+����c��CH3COO������c��H+����c��OH�����Ĵ�С��ϵ��c��Na+��=c��CH3COO������c��H+��=c��OH����������������������ǣ�����c��Na+��=c��CH3COO������c��H+��=c��OH������
�ڷ�Ӧ����Һ��������c��H+��=c��OH��=10-7mol/L��c��Na+��=c��CH3COO����=bmol/L�������ĵ��볣��Ϊ=c(H+)c(CH3COO-)/c(CH3COOH)=10-7��b/(a-b)= 10��7b/(a-b)��
�������������������10��7b/(a-b)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ���ͭ��ʴ�������������ܣ���ŵ����Ϊ2Li+Cu2O+H2O=2Cu+2Li++2OH-������˵������ȷ����( )

A. �ŵ�ʱ��Li+������������Cu���ƶ�
B. �ŵ�ʱ�����Ӵ�﮵缫ͨ����������ͭ�缫
C. �ŵ�ʱ��﮵缫Ϊ����������������Ӧ
D. �øõ�ص�ⱥ��ʳ��ˮ��ÿ����1mol����(2Cl--2e-��Cl2)ʱ��ͭ�������ı�64g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(FexNy)�ڴż�¼�����������Ź㷺��Ӧ��ǰ����ijFexNy���Ʊ���������������ͪ���Ҵ����롣
(1)Fe3����̬��������Ų�ʽΪ________��
(2)��ͪ(CH3CCH3O)������̼ԭ�ӹ�����ӻ�������________��1 mol��ͪ�����к��ЦҼ�����ĿΪ________��
(3)C��H��O����Ԫ�صĵ縺����С�����˳��Ϊ__________________��
(4)�Ҵ��ķе���ڱ�ͪ��������Ϊ________________________________________��
(5)ijFexNy�ľ�����ͼ1��ʾ��Cu������ȫ����þ�����aλ��Fe����bλ��Fe���γ�Cu����Ͳ���Fe(x��n)CunNy��FexNyת��Ϊ����Cu����Ͳ���������仯��ͼ2��ʾ�����и��ȶ���Cu����Ͳ���Ļ�ѧʽΪ________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵ�����г����Ŀ�����ϡ������Fe(OH)3������īˮ��NaCl��Һ��ϡ�������ܹ۲쵽������������
A.�٢ۢܢ�B.�ڢۢܢ�C.�٢ڢۢ�D.�ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ijС���ͬѧ��̽��NH3��һϵ�з�Ӧ�õ�HNO3��NH4NO3�Ĺ��̣�NH3��ת����������ͼ��ʾ��
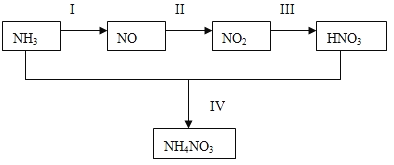
�ס�����ͬѧ�ֱ���ͼ��ʾװ�ý���ʵ�顣����A��Bװ���еĿ�ѡҩƷ��Ũ��ˮ��30��H2O2��Һ������ˮ��NaOH���塢MnO2
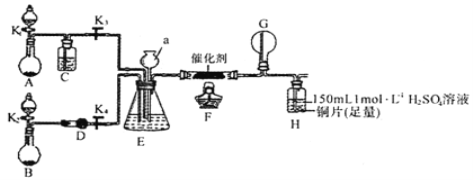
��װ��A��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ__________��װ��E�ж������ã����й���װ��E�����û�������ʢҺ���˵���У�����ȷ����_________�������������ĸ����
a��ʹ������������ֻ�� b������ͨ�백���������������
c��ƽ��װ���ڵ�ѹǿ d����ƿ��Һ���DZ���ʳ��ˮ
�ڼ�ͬѧ�ȵ�ȼ�ƾ��ƣ��ٴ�K1��K2��K3��K4����Ӧһ��ʱ��ɹ�ģ���˷�Ӧ����,����ʵ���в������������ͨ��װ��Hһ��ʱ���H�е���Һ�����ɫ��������ͭƬ�����뷴Ӧ�����ӷ���ʽΪ_______�����Ƶõİ�������I�����III��˳����ȫת��Ϊ���ᣬ��ʹHװ����������ҺΪ������CuSO4��Һ������Cu2+��ˮ�⣩�����������谱���ڱ�״���µ����Ϊ______L������������ͭ��Ӧ�����Ļ�ԭ����ȫ���ų���Ӧװ�ã���
����ͬѧΪģ�����IV�ķ�Ӧ���ڼ�ͬѧ�����Ļ����϶Ը�װ�ý��������и����е�һ�������ʹG��Բ����ƿ�в����������̣�����Ϊ���������_________�������������ĸ����
a���ر�K3��Ϩ��ƾ��� b���ر�K4��Ϩ��ƾ��� c���ر�K3��K4��Ϩ��ƾ���
�ܱ�ͬѧ��Ϊ��ϵ��ʵ��װ�ô���һ�����Ե����ȱ�ݣ�����Ϊ�����ȱ����__________��
(2)ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ��������
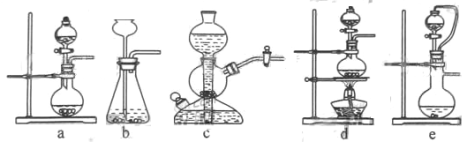
�������������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ���� _____����д��ĸ����
������������������Ʒ�Ӧ��ȡ3.36L����״�������������������40%�������ƣ��������������������������ƣ����������ȡ���������� _______ g������һλС������
��ij�ȵ糧�Ͽմ��������������������س��꣬�ֶԸ�������ˮ��Ʒ����̽����������pH��ֽ�ⶨ��ˮ��Ʒ��pH����������Ϊ_______________�������ƷpHԼΪ3��Ϊ��һ��̽����SO2���γ���������ʣ���һ������SO2ͨ������ˮ�У����pHΪ3����Һ��Ȼ����Һ��ΪA��B���ݣ�����ҺB�����ڿ����У����ܱձ����A��ȣ����ú����ҺB��ˮ�ĵ���̶Ƚ�_______�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ�����˵��������� ( )
A.þ�Ͻ����������ɻ�������͵�����
B.�Ȼ�������Ҫ�Ļ���ԭ�ϣ�����Ȼ�����Һ���Ƶý�����
C.ʳƷ��װ�к�ɫ���۵Ĵ���С�������ڷ�ֹʳƷ��������
D.������Һ������ȥ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ�����һ���������ʪ�Թؽ���ҩ���ͨ�����·����ϳɣ�

��1����Ӧ���м�����Լ�X�ķ���ʽΪC8H8O2��X�Ľṹ��ʽΪ____��
��2���л���D��һ�������·�����ȥ��Ӧ��д����Ӧ�Ļ�ѧ����ʽ____��
��3����������֪ʶ����������Ϣ��д����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ(���Լ�����)____���ϳ�·������ͼʾ�����£�CH2
�ĺϳ�·������ͼ(���Լ�����)____���ϳ�·������ͼʾ�����£�CH2![]() CH2
CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH��
CH3CH2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ԭ��ij��ĵ���������ȷ����Ԫ�ص�ԭ����������
A.K������2������B.L������3������
C.�������8������D.�������5������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com