
【题目】(1)某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程,NH3的转化过程如下图所示。
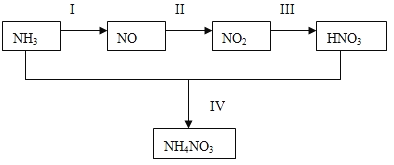
甲、乙两同学分别按下图所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30%H2O2溶液、蒸馏水、NaOH固体、MnO2
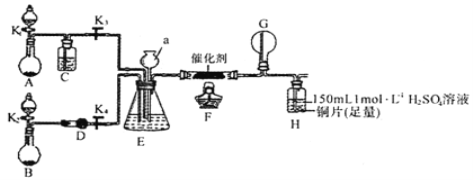
①装置A的圆底烧瓶中发生反应的化学方程式为__________。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是_________(填下列序号字母)。
a.使氨气和氧气充分混合 b.控制通入氨气和氧气的体积比
c.平衡装置内的压强 d.锥形瓶内液体是饱和食盐水
②甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_______,若制得的氨气仅按I→Ⅱ→III的顺序完全转化为硝酸,欲使H装置中所得溶液为纯净的CuSO4溶液(忽略Cu2+的水解),理论上所需氨气在标准状况下的体积为______L(假设硝酸与铜反应产生的还原产物全部排出反应装置);
③乙同学为模拟过程IV的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是_________(填下列序号字母)。
a.关闭K3并熄灭酒精灯 b.关闭K4并熄灭酒精灯 c.关闭K3、K4并熄灭酒精灯
④丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷是__________。
(2)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
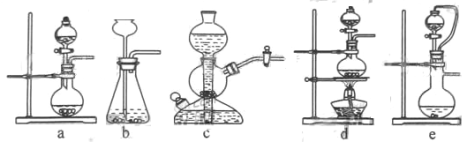
①如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 _____(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 _______ g(保留一位小数)。
③某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为_______________,测得样品pH约为3;为进一步探究由SO2所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,将溶液B久置于空气中,与密闭保存的A相比,久置后的溶液B中水的电离程度将_______(填“增大”、“减小”或“不变”)。
【答案】2H2O2=2H2O+O2↑ d 3Cu+ 8H++2NO3-=3Cu2+ +2NO↑+4H2O 2.24 a 缺少尾气处理装置 ae 33.1 取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸中央,待变色后与对照标准比色卡读数 减小
【解析】
试题(1)①A、B是制备氨气和氧气的装置,C、D 是干燥装置,用碱石灰干燥氨气 、用浓硫酸干燥氧气,所以用A制备氧气、B制备氨气;装置E有多种作用,如使氨气和氧气充分混合,通过观察产生气泡的速率控制通入氨气和氧气的体积比,通过长颈漏斗平衡装置中的压强,氨气易溶于食盐水,锥形瓶中不能盛饱和食盐水;② 铜能与硝酸反应,H中的溶液变成蓝色,说明铜与硝酸反应生成硝酸铜;欲使H装置中所得溶液为纯净的CuSO4溶液,根据硫酸的物质的量可知消耗铜的物质的量,氮元素被铜还原为NO,根据电子守恒,可计算N元素的物质的量,根据元素守恒,可知氨气的物质的量;③ 使G处圆底烧瓶中产生大量白烟,需通入氨气和硝酸反应;④ 缺少尾气处理装置;(2)① 用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置bc。②由硫元素守恒可得:Na2SO3~SO2,因此需纯净Na2SO3的质量为:m(Na2SO3)=126g·mol-1×3.36L/22.4 L·mol-1=18.9g;根据有40%亚硫酸钠(质量分数)被氧化成硫酸钠,计算需要称取该亚硫酸钠的质量。③根据用PH试纸测PH的方法回答;久置后的溶液B中亚硫酸被氧化为硫酸。
解析:(1)根据以上分析,①装置A中用过氧化氢制取氧气,发生反应的化学方程式为2H2O2=2H2O+O2↑;装置E有多种作用,如使氨气和氧气充分混合,通过观察产生气泡的速率控制通入氨气和氧气的体积比,通过长颈漏斗平衡装置中的压强,氨气易溶于食盐水,锥形瓶中不能盛饱和食盐水,故d错误;② 铜能与硝酸反应,H中的溶液变成蓝色,说明铜被硝酸氧化成铜离子,反应的离子方程式是3Cu+ 8H++2NO3-=3Cu2+ +2NO↑+4H2O;欲使H装置中所得溶液为纯净的CuSO4溶液,![]() ,根据元素守恒,可知消耗铜的物质的量是0.15mol,硝酸被铜还原为
,根据元素守恒,可知消耗铜的物质的量是0.15mol,硝酸被铜还原为![]() ,根据电子守恒,
,根据电子守恒,![]() , N元素的物质的量是0.1mol ,根据元素守恒,氨气的物质的量是0.1mol,氨气在标准状况下的体积是
, N元素的物质的量是0.1mol ,根据元素守恒,氨气的物质的量是0.1mol,氨气在标准状况下的体积是![]() ;③ 使G处圆底烧瓶中产生大量白烟,需通入氨气和硝酸反应,所以需要的操作是关闭K3并熄灭酒精灯,选a;④ 该装置的缺陷是缺少尾气处理装置;(2)① 用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置bc,故选ae装置。②根据关系式Na2SO3~SO2,需纯净Na2SO3的质量为:m(Na2SO3)=126g·mol-1×3.36L/22.4 L·mol-1=18.9g;有40%亚硫酸钠被氧化为硫酸钠,氧化前亚硫酸钠的质量是18.9g÷60%=31.5g,被氧化的亚硫酸钠的质量31.5g×40%=12.6g,生成硫酸钠的质量是12.6g
;③ 使G处圆底烧瓶中产生大量白烟,需通入氨气和硝酸反应,所以需要的操作是关闭K3并熄灭酒精灯,选a;④ 该装置的缺陷是缺少尾气处理装置;(2)① 用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置bc,故选ae装置。②根据关系式Na2SO3~SO2,需纯净Na2SO3的质量为:m(Na2SO3)=126g·mol-1×3.36L/22.4 L·mol-1=18.9g;有40%亚硫酸钠被氧化为硫酸钠,氧化前亚硫酸钠的质量是18.9g÷60%=31.5g,被氧化的亚硫酸钠的质量31.5g×40%=12.6g,生成硫酸钠的质量是12.6g![]() 14.2g,因此称取变质样品的质量应为:18.9g+14.2g =33.1g。③用pH试纸测定雨水样品的pH,操作方法为:取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸中央,待变色后与对照标准比色卡读数;久置后的溶液B中亚硫酸被氧化为硫酸,弱酸变为强酸,PH减小。
14.2g,因此称取变质样品的质量应为:18.9g+14.2g =33.1g。③用pH试纸测定雨水样品的pH,操作方法为:取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸中央,待变色后与对照标准比色卡读数;久置后的溶液B中亚硫酸被氧化为硫酸,弱酸变为强酸,PH减小。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物Z是重要的医药中间体,其合成路线如下:

下列叙述正确的是
A. 化合物X、Y、Z和H2发生加成反应后的产物均含2个手性碳原子
B. 两分子X可生成一个含有3个六元环的分子
C. 化合物Z可发生氧化反应、取代反应、加聚反应和缩聚反应
D. 化合物X与NaHCO3和Na2CO3溶液都能反应,且都可以产生CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:

下列说法正确的是
A. 化合物Z可以发生取代、加成、氧化、加聚反应
B. 1mol化合物Y最多与1molNaOH发生反应
C. 化合物Y中所有原子可能在同一平面内
D. 可以用NaOH溶液检验化合物Z中有没有残留的化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学原理是中学化学学习的重要内容。请回答下列问题:
(1)①己知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是__________________________。
②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是________,A是____。

(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:

①从反应开始至平衡时,用CO表示化学反应速率为________,该温度下的平衡常数为__;
②5min至10min时速率变化的原因可能是__________________;
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化);如果溶液pH=7,此时V的取值___20.00(填“>”、“=”或“<”),溶液中c(Na+)、c(CH3COO﹣)、c(H+)、c(OH﹣)的大小关系是_____________________;
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为_______(用含有a、b字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是
A. CO+H2O![]() CO2+H2 B. 3NO2+H2O=2HNO3+NO
CO2+H2 B. 3NO2+H2O=2HNO3+NO
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2F2+2H2O=4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
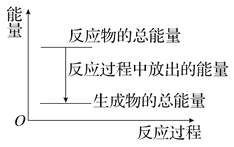
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素在周期表中的位置如图,则下列说法错误的是

A. 若Y的最简单氢化物的沸点比M的低,则X单质可与强碱溶液反应
B. 简单阴离子半径M>Z>Y
C. 若Y的氢化物水溶液呈碱性,则X的氧化物不与任何酸反应
D. 最高价氧化物对应水化物的酸性Z>M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com