
【题目】标准状况下,下列物质中,体积最大的是
A.36g H2OB.11.2LO2C.NA个CO2D.0.5mol H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】SO2与漂粉精是常用的漂白剂。某兴趣小组对它们的漂白原理进行探究。过程如下:
I. 探究SO2的漂白性
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中,观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a. 0.1 mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b. 0.1 mol/L NaHS03溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c. 0.1 mol/L Na2SO3溶液( pH=10) | 溶液立即褪色 | |
d. pH=10NaOH溶液 | 红色溶液不变色 | |
e. pH=2H2SO4溶液 | 红色溶液不变色 |
(1)实验d的目的是____________。
(2)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是____________。
(3)已知S02使品红溶液褪色过程是可逆的。兴趣小组继续试验:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
请用离子方程式和必要的文字说明出现上述现象的原因____________。
II. 探究SO2与漂粉精的反应
实验三:
操作 | 现象 |
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
小组同学对上述现象进行探究:
(1)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(2)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是____________。
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀x中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是____________。
②用离子方程式解释现象iii中黄绿色褪去的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
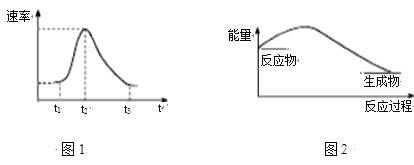
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列分散系:①有尘埃的空气②稀硫酸③Fe(OH)3胶体④墨水⑤NaCl溶液⑥稀豆浆,能观察到丁达尔现象的是
A.①③④⑥B.②③④⑥C.①②③⑤D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
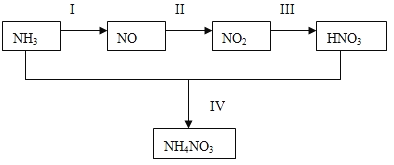
【题目】(1)某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程,NH3的转化过程如下图所示。
甲、乙两同学分别按下图所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30%H2O2溶液、蒸馏水、NaOH固体、MnO2
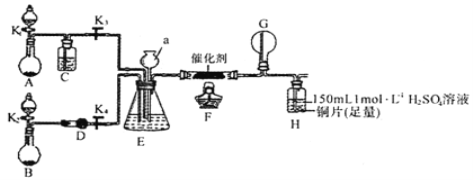
①装置A的圆底烧瓶中发生反应的化学方程式为__________。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是_________(填下列序号字母)。
a.使氨气和氧气充分混合 b.控制通入氨气和氧气的体积比
c.平衡装置内的压强 d.锥形瓶内液体是饱和食盐水
②甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_______,若制得的氨气仅按I→Ⅱ→III的顺序完全转化为硝酸,欲使H装置中所得溶液为纯净的CuSO4溶液(忽略Cu2+的水解),理论上所需氨气在标准状况下的体积为______L(假设硝酸与铜反应产生的还原产物全部排出反应装置);
③乙同学为模拟过程IV的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是_________(填下列序号字母)。
a.关闭K3并熄灭酒精灯 b.关闭K4并熄灭酒精灯 c.关闭K3、K4并熄灭酒精灯
④丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷是__________。
(2)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
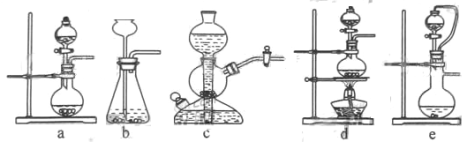
①如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 _____(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 _______ g(保留一位小数)。
③某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为_______________,测得样品pH约为3;为进一步探究由SO2所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,将溶液B久置于空气中,与密闭保存的A相比,久置后的溶液B中水的电离程度将_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1molX气体和1molY气体混合于2L密闭容器中,发生如下反应:
3X(g)+2Y(g)![]() nZ(g)+2W(g) △H<0,2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1。
nZ(g)+2W(g) △H<0,2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1。
请完成下列问题:
(1)n= ____________。
(2)2min末时Y的转化率_________。
(3)起始容器内压强与平衡时容器内压强之比_________。
(4)已知:可逆反应达到平衡状态后,若改变影响平衡的一个外界条件(如温度、浓度、压强等),平衡将向着减弱这种改变的方向移动。下列条件变化,既能加快反应速率又能使平衡向正反应方向移动的是_________(填选项字母)。
a.升高温度 b.再充入1molX气体 c.增大容器容积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行如下反应N2+3H2![]() 2NH3,下列情况一定能说明反应已达到平衡的是
2NH3,下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com