
【题目】把1molX气体和1molY气体混合于2L密闭容器中,发生如下反应:
3X(g)+2Y(g)![]() nZ(g)+2W(g) △H<0,2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1。
nZ(g)+2W(g) △H<0,2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1。
请完成下列问题:
(1)n= ____________。
(2)2min末时Y的转化率_________。
(3)起始容器内压强与平衡时容器内压强之比_________。
(4)已知:可逆反应达到平衡状态后,若改变影响平衡的一个外界条件(如温度、浓度、压强等),平衡将向着减弱这种改变的方向移动。下列条件变化,既能加快反应速率又能使平衡向正反应方向移动的是_________(填选项字母)。
a.升高温度 b.再充入1molX气体 c.增大容器容积
【答案】4 20% 20/21 b
【解析】
列出三段式进行分析。
3X(g)+2Y(g)![]() nZ(g)+2W(g)
nZ(g)+2W(g)
起始浓度mol·L-1 0.5 0.5 0 0
变化浓度mol·L-1 0.15 0.1 0.2 0.1
平衡浓度mol·L-1 0.35 0.4 0.2 0.1
(1)根据速率之比等于化学计量数之比计算n的值.
(2)Y的转化率=反应的Y物质的量/Y起始物质的量×100%;
(3)起始容器内压强与平衡时容器内压强之比=起始容器内总物质的量与平衡时容器内总物质的量之比;
(4)3X(g)+2Y(g)![]() 4Z(g)+2W(g) △H<0是气体体积增大的放热反应,以此分析。
4Z(g)+2W(g) △H<0是气体体积增大的放热反应,以此分析。
2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1,Z平衡浓度为0.1 mol·L-1·min-1×2min=0.2 mol·L-1。列出三段式:
3X(g)+2Y(g)![]() nZ(g)+2W(g)
nZ(g)+2W(g)
起始浓度mol·L-1 0.5 0.5 0 0
变化浓度mol·L-1 0.15 0.1 0.2 0.1
平衡浓度mol·L-1 0.35 0.4 0.2 0.1
(1)根据速率之比等于化学计量数之比计算n的值。
速率之比等于化学计量数之比,0.2mol/(L·min):0.1mol/(L·min)=n:2,解得n=4;
(2)Y的转化率=反应的Y物质的量/Y起始物质的量×100%=0.1mol/0.5mol×100%=20%;
(3)起始容器内压强与平衡时容器内压强之比=起始容器内总物质的量与平衡时容器内总物质的量之比=(0.5+0.5):(0.35+0.4+0.2+0.1)=20:21;
(4)3X(g)+2Y(g)![]() 4Z(g)+2W(g) △H<0是气体体积增大的放热反应,
4Z(g)+2W(g) △H<0是气体体积增大的放热反应,
a.升高温度平衡逆向进行,故不符;
b.再充入1molX气体,既能加快反应速率又能使平衡向正反应方向移动,故符合;
c.增大容器容积,减慢反应速率,能使平衡向正反应方向移动,故不符;
故选b。


科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是
A. CO+H2O![]() CO2+H2 B. 3NO2+H2O=2HNO3+NO
CO2+H2 B. 3NO2+H2O=2HNO3+NO
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2F2+2H2O=4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是( )

A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收多余的SO2,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
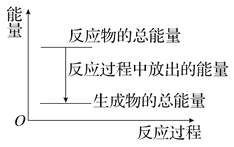
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
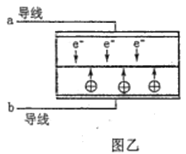
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
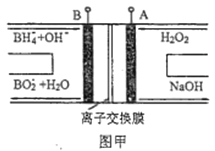
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列现象或性质能体现钠的物理性质的是
①钠燃烧时发出黄色的火焰 ②钠燃烧时生成过氧化钠 ③熔点低 ④密度比水⑤热和电的良导体 ⑥钠有很强的还原性
A. ①③④⑤⑥ B. ①②③④⑤ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com