
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
【答案】C
【解析】试题分析:A.点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),故A错误;B.点③中pH=7,则c(OH-)=c(H+),则点③中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;C.点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故C正确;D.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),在③中Na元素的物质的量与醋酸的总物质的量相同,由于醋酸根离子要水解,所以c(Na+)>c(CH3COOH),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D错误;故选C。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3—二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:

下列叙述正确的是
A. 可用溴水可以鉴别化合物Ⅰ和Ⅱ
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl![]() 和AlCl
和AlCl![]() 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3c.MnO2d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是___________________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解热镇痛药扑炎痛可由化合物X、Y在一定条件下反应合成。下列有关叙述正确的是
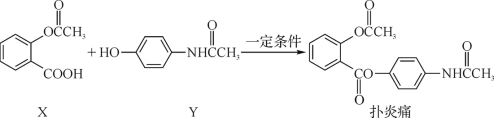
A. 扑炎痛的分子式为C17H16NO5
B. 可用FeCl3溶液检验扑炎痛中是否含有化合物Y
C. 扑炎痛在酸性条件下水解最终可以得到4种物质
D. 与化合物X互为同分异构体且属于二元羧酸的化合物有10种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH4与CH3CH3的叙述错误的是
A. CH4与CH3CH3互为同系物
B. CH4与Cl2在光照下反应有四种产物
C. CH4与Cl2在光照下反应属于取代反应
D. CH3CH3与Cl2在光照下可以发生反应CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是( )

A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收多余的SO2,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
(1)实验室用如图所示装置B制取连二亚硫酸钠(Na2S2O4)。

①实验中要控制生成SO2的速率,可采取的措施有(至少写一条)_________
②B装置中用甲醇作溶剂,C中NaOH的作用是__________。
(2)二氧化硫能够抑制细菌的滋生,可用作防腐剂,但必须严格按照国家标准使用。实验室用已知浓度的碘水来测定某粉丝样品中二氧化硫的残留量,装置如图所示。

①将粉丝样品粉碎,准确称取5.0 g,放入三颈烧瓶中,加入稀硫酸浸泡30分钟,再加适量蒸馏水,加热1小时(加热装置略去),使二氧化硫完全进入吸收装置。
②往吸收装置中加入3滴淀粉溶液作指示剂,再逐滴加入0.001 mol·L-1 I2标准溶液。
当溶液颜色__________时,恰好完全反应,写出反应的离子方程式________;恰好反应时消耗I2标准溶液10.00 mL,测得样品中SO2的残留量为________ g·kg-1。
③在配制I2标准溶液,定容加水时仰视刻度线,则测得SO2含量_______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com