
【题目】离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl![]() 和AlCl
和AlCl![]() 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3c.MnO2d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是___________________(用离子方程式说明)。
【答案】负 4Al2Cl7-+3e-===Al+7AlCl4- H2 3 bd 不能 Fe2O3+6H+===2Fe3++3H2O、Fe+2Fe3+===3Fe2+(或只写Fe+2Fe3+===3Fe2+)
【解析】
(1)要在钢制品上电镀铝,则镀件钢制品应接电源的负极;阴极反应为Al得电子被还原,电极反应式为4Al2Cl7-+3e-===Al+7AlCl4-;若改用AlCl3水溶液作电解液,则阴极产物为H2。答案:负 、4Al2Cl7-+3e-===Al+7AlCl4- 、 H2。
(2)NaOH溶解铝的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2 ![]() ,当反应转移6mol电子时,所得还原产物H2的物质的量为3mol。答案:3.
,当反应转移6mol电子时,所得还原产物H2的物质的量为3mol。答案:3.
(3)铝热反应中,Mg为引燃剂,KClO3为助燃剂,故选择bd项。答案:bd。
滴加KSCN溶液无明显现象,说明溶液中不含有Fe3+,但不能说明固体混合物中无Fe2O3,因为Fe3+能被Fe 还原成Fe3+,离子方程式为Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+===3Fe2+(或只写Fe+2Fe3+===3Fe2+)。答案:不能 、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+===3Fe2+(或只写Fe+2Fe3+===3Fe2+)


科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是
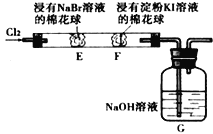
A. E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B. F处棉花球变成蓝色,说明Br2的氧化性比I2强
C. E处发生反应的离子方程式为:Cl2 + 2Br- = 2Cl- + Br2
D. G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电子式的相关描述中正确的是( )
A. CCl4的电子式为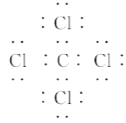
B. CaCl2的电子式
C. 由氨气的电子式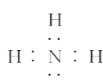 可知,每个氨气分子含有8个电子
可知,每个氨气分子含有8个电子
D. 用电子式表示氯化氢的形成过程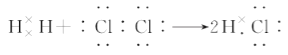
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
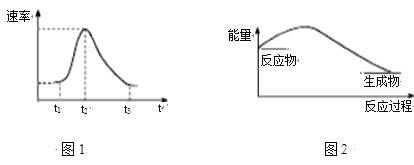
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2(21℃)、NO(–152℃)
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_____________;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,A中产生红棕色气体。
①确认A中产生气体含有NO,依据的现象是_____________________________。
②装置E的作用是_______________________________________________________。
(3)如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com