
【题目】扁桃酸衍生物Z是重要的医药中间体,其合成路线如下:

下列叙述正确的是
A. 化合物X、Y、Z和H2发生加成反应后的产物均含2个手性碳原子
B. 两分子X可生成一个含有3个六元环的分子
C. 化合物Z可发生氧化反应、取代反应、加聚反应和缩聚反应
D. 化合物X与NaHCO3和Na2CO3溶液都能反应,且都可以产生CO2气体
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO、SiO2等氧化物杂质)制取金属锌的流程如图所示。回答下列问题:

(1)ZnFe2O4中Fe的化合价为______价,已知ZnFe2O4能溶于酸,则酸浸时ZnFe2O4反应的离子方程式为_________________________,酸浸后滤渣的成分主要是__________。
(2)酸浸时一般要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可以采用的方法是___________________(任答一条即可)
(3)净化Ⅰ中H2O2参与反应的离子方程式为_________________________________,试剂X的作用是_______________,
(4)净化Ⅱ中得到的Y是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2与漂粉精是常用的漂白剂。某兴趣小组对它们的漂白原理进行探究。过程如下:
I. 探究SO2的漂白性
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中,观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a. 0.1 mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b. 0.1 mol/L NaHS03溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c. 0.1 mol/L Na2SO3溶液( pH=10) | 溶液立即褪色 | |
d. pH=10NaOH溶液 | 红色溶液不变色 | |
e. pH=2H2SO4溶液 | 红色溶液不变色 |
(1)实验d的目的是____________。
(2)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是____________。
(3)已知S02使品红溶液褪色过程是可逆的。兴趣小组继续试验:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
请用离子方程式和必要的文字说明出现上述现象的原因____________。
II. 探究SO2与漂粉精的反应
实验三:
操作 | 现象 |
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
小组同学对上述现象进行探究:
(1)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(2)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是____________。
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀x中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是____________。
②用离子方程式解释现象iii中黄绿色褪去的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的“铜腐蚀现象”产生电能,其放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,电子从锂电极通过负载流向铜电极
C. 放电时,锂电极为负极,发生氧化反应
D. 用该电池电解饱和食盐水,每产生1mol氯气(2Cl--2e-→Cl2)时,铜极质量改变64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电子式的相关描述中正确的是( )
A. CCl4的电子式为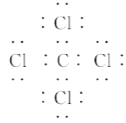
B. CaCl2的电子式
C. 由氨气的电子式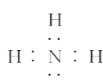 可知,每个氨气分子含有8个电子
可知,每个氨气分子含有8个电子
D. 用电子式表示氯化氢的形成过程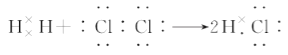
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
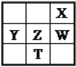
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程,NH3的转化过程如下图所示。
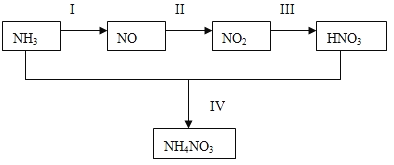
甲、乙两同学分别按下图所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30%H2O2溶液、蒸馏水、NaOH固体、MnO2
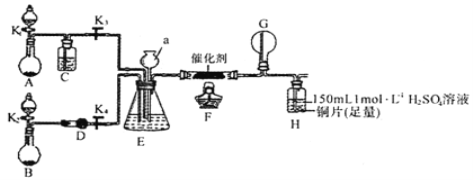
①装置A的圆底烧瓶中发生反应的化学方程式为__________。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是_________(填下列序号字母)。
a.使氨气和氧气充分混合 b.控制通入氨气和氧气的体积比
c.平衡装置内的压强 d.锥形瓶内液体是饱和食盐水
②甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_______,若制得的氨气仅按I→Ⅱ→III的顺序完全转化为硝酸,欲使H装置中所得溶液为纯净的CuSO4溶液(忽略Cu2+的水解),理论上所需氨气在标准状况下的体积为______L(假设硝酸与铜反应产生的还原产物全部排出反应装置);
③乙同学为模拟过程IV的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是_________(填下列序号字母)。
a.关闭K3并熄灭酒精灯 b.关闭K4并熄灭酒精灯 c.关闭K3、K4并熄灭酒精灯
④丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷是__________。
(2)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
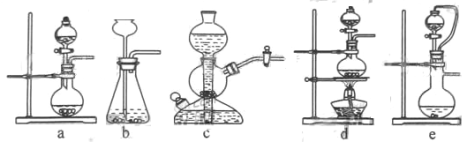
①如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 _____(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 _______ g(保留一位小数)。
③某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为_______________,测得样品pH约为3;为进一步探究由SO2所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,将溶液B久置于空气中,与密闭保存的A相比,久置后的溶液B中水的电离程度将_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com