
| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有甲烷 | D. | 一定没有乙烯 |
分析 标况下3.584L二氧化碳的物质的量为:n(CO2)=$\frac{3.584L}{22.4L/mol}$=0.16mol,根据混合物的物质的量,求出混合的平均化学式,然后结合选项分析.
解答 解:标况下3.584L二氧化碳的物质的量为:n(CO2)=$\frac{3.584L}{22.4L/mol}$=0.16mol,两种气态烃共0.1mol,则混合烃的平均化学式C1.6Hn,由于是混合物,则肯定含有C原子数小于1.6的烃,即一定含有甲烷,故B正确;
故选B.
点评 本题考查了有机物分子式确定,题目难度不大,注意掌握利用平均分子组成判断烃的组成的方法,侧重于考查学生的分析能力和计算能力


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
 .
.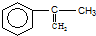 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: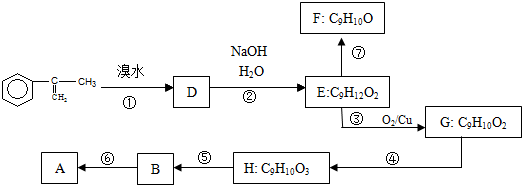
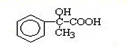
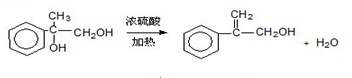 .两分子H之间发生反应生成六元环酯化学方程式是:2
.两分子H之间发生反应生成六元环酯化学方程式是:2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$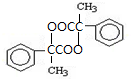 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 任何化学物质中均存在化学键 | |
| D. | 全部由非金属元素形成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
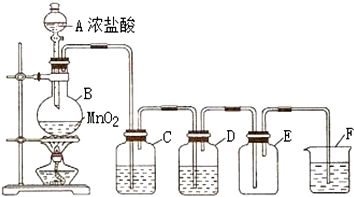
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com