
| A. | 乙烯、乙炔 | B. | 乙烯、丙烯 | C. | 苯、乙烷 | D. | 苯、甲苯 |
科目:高中化学 来源: 题型:填空题
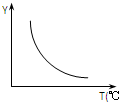 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. |  1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. |  异戊烷 异戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4>CCl4>CBr4>CI4 | B. | Na>Mg>Al | ||
| C. | SiO2>H2O>CO2 | D. | 晶体硅>SiC>金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

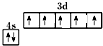 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.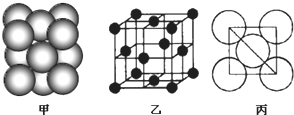
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-═Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com