
【题目】化学与生活密切相关。下列叙述中错误的是
A.环境中杀灭新型冠状病毒可用“84”消毒液
B.食品中的抗氧化剂可用维生素C
C.治疗胃酸过多可用CaCO3和Ca(OH)2
D.除去工业废水中的Cu2+可用FeS
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g)+B(g)![]() xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
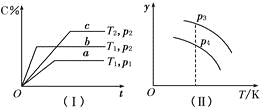
A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示B的质量分数
C.p3>p4,y轴表示C的质量分数
D.p3>p4,y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂化验员检验某含有KBrO3、KBr及惰性物的样品。化验员称取了该固体样品1.000 g,加水溶解后配成100 mL溶液X。
Ⅰ. 取25.00 mL溶液X,加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-;
还原为Br-;
Ⅱ. 去除过量的SO![]() 后调至中性;
后调至中性;
Ⅲ. 加入K2CrO4作指示剂,用0.100 0 mol·L-1AgNO3标准溶液滴定Br-至终点,消耗 AgNO3标准溶液11.25 mL;
Ⅳ. 另取25.00 mL溶液X,酸化后加热,再用碱液调至中性,测定过剩Br-,消耗上述AgNO3标准溶液3.75 mL。
已知:①25 ℃时,Ag2CrO4(砖红色)的Ksp=1.12×10-12,AgBr(浅黄色)的Ksp=5.0×
10-15;
②Ⅳ中酸化时发生反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O
+5Br-+6H+=== 3Br2+3H2O
请回答:
(1)步骤Ⅰ中,反应的离子方程式为________________________________。
(2)步骤Ⅲ中,滴定终点的现象为_____________________________________________。
(3)步骤Ⅳ中,加热的目的是________________________。
(4)计算试样中KBrO3质量分数。(写出计算过程,结果保留3位有效数字)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的8种元素,完成下列小题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①的元素符号是__________, 元素⑤的原子结构示意图为____________。
(2)元素②的简单氢化物的化学式为__________,此氢化物遇元素⑧的氢化物时,会产生大量的____________(填现象)
(3)题目所给的8种元素中,金属性最强的元素是___________(填元素名称),非金属性最强的元素是_______(填元素名称),最高价氧化物对应水化物具有两性的是_______(填化学式,下同),最高价氧化物对应水化物碱性最强的是________,元素②和③的简单氢化物较稳定的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰(图甲)中含共价键数目为4NA
B.12g金刚石(图乙)中含有σ键数目为4NA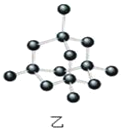
C.44g干冰(图丙)中含有NA个晶胞结构单元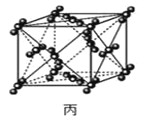
D.12g石墨(图丁)中含σ键数目3NA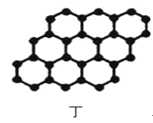
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
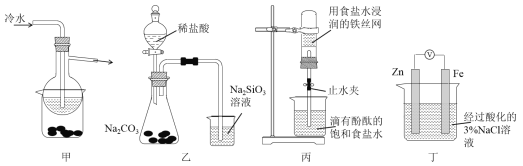
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物之一,也是重要的化工原料。
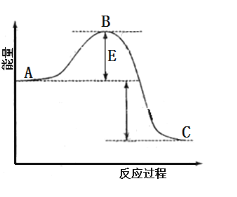
(1)某温度下,反应![]()
![]() 的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
(2)将0.1 mol O2和0.2 mol SO2通入一容积可变的容器中进行反应:![]() 。测得SO2的平衡转化率随温度、压强的变化如图。
。测得SO2的平衡转化率随温度、压强的变化如图。
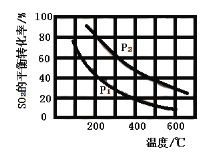
①![]() ______(填“>”“<”或“=”)
______(填“>”“<”或“=”)![]() 。
。
②若在300℃、压强为![]() 时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
③反应![]() 在
在![]() 时刻达到平衡后,在
时刻达到平衡后,在![]() 时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
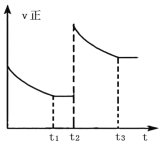
A.加压B.向体系中再通入一定量SO2
C.升高温度D.加催化剂
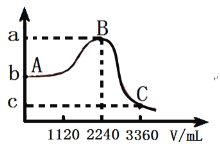
(3)常温下,向1L![]() 的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则
的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则![]() _____;
_____;![]() _____;
_____;![]() _____。已知:常温下,氢硫酸的
_____。已知:常温下,氢硫酸的![]() 、
、![]() ,亚硫酸的
,亚硫酸的![]() 、
、![]() ;
;![]() 。
。
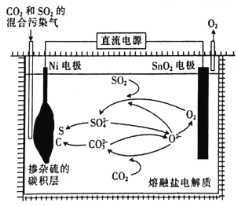
(4)用电解法处理CO2和SO2的混合污染气的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层,则与Ni电极相连的是电源的______(填“正极”或“负极”);阳极的电极反应式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com