
【题目】按要求填空:
(1)L层电子数为K、M层电子数之和的原子,填写微粒的结构示意图:___;
(2)与Ne原子电子层结构相同的负二价阴离子,填写微粒的轨道表示式:___;电子式是___;
(3)在1~18号元素中,气态氢化物的水溶液呈碱性的元素原子的电子式:___;
(4)元素M的离子与NH4+所含电子数和质子数均相同,则M原子的最外层的电子排布式是___。
【答案】
![]()
![]()
![]() 3s1
3s1
【解析】
(1)L层电子数为K层、M层电子数之和的原子为硫原子,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)与Ne原子电子层结构相同的﹣2价阴离子是氧离子,氧离子结构示意图 ,电子排布式1s22s22p6,其轨道排布式为
,电子排布式1s22s22p6,其轨道排布式为![]() ,氧离子带有2个负电荷,其电子式为
,氧离子带有2个负电荷,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)在1~18号元素中,气态氢化物的水溶液呈碱性的氢化物为氨气,气态氢化物的水溶液呈碱性的元素原子为氮原子,N原子最外层电子数为5,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)元素M的离子与NH4+所含电子数和质子数均相同,质子数11,电子数10,则M为钠元素,最外层1个电子,最外层的电子排布式是3s1,故答案为:3s1。


科目:高中化学 来源: 题型:
【题目】将4 mol A气体和1mol B气体在2 L的容器内混合,在一定条件下发生反应: 2A(g) +B(g)![]() 3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
A. 用物质A表示反应的平均速率为v(A)= 0.4 mol·(L·min)-1
B. 2 min时A、B、C三种气体的总量为5mol
C. 2 min时B的转化率为20%
D. 若2 min后该反应达平衡,则各种气体的量不再变化,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是

A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
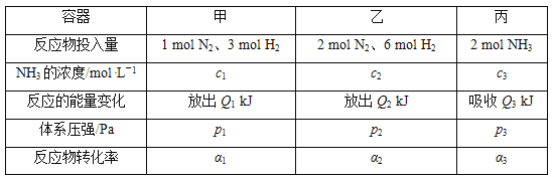
A. 2p1=2p3<p2
B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1
D. Q1+Q3=92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子数之比为___;氧原子数之比为____;相同条件下的体积之比为____。
(2)标准状况下,1.7gNH3与标准状况下___LH2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为____,R的相对原子质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
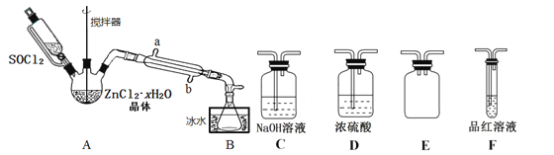
①用原理解释SOCl2在该实验中的作用:_________________________________。
②装置的连接顺序为A→B→______________________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl2的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加人足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=6HCl+N2。下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应属于复分解反应
C.该反应属于氧化还原反应
D.该反应中Cl2是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com