
【题目】中美科学家在银表面首次获得了二维结构的硼烯,该科研成果发表在顶级刊《Science》上,并获得重重点推荐。二维结构的硼烯如图所示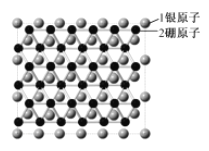 ,下列说法错误的是( )
,下列说法错误的是( )
A.1mol硼原子核外电子数为3NA
B.1molBF3分子中共价键的数目为3NA
C.1molNaBH4与水反应转移的电子数为4NA
D.硼烯有望代替石墨烯作“硼烯一钠基“电池的负极材料
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
B.水分子中O-H键的键能很大,因此水的沸点较高
C.Na2O2中 既含有离子键又含有共价键,但Na2O2属于离子化合物
D.1 mol NH3中含有共用电子对数为4NA (NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol甲醇分子中含有的共价键数为4NA
B.2.4 g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5NA
D.1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究发现:硫化态的钴、钼、硫相互作用相(所谓“CoMoS”相)和噻吩(分子式为C4H4S)的加氢脱硫反应(C4H4S+4H2→C4H10+H2S)活性有线性关系。请回答下列有关问题:
(1)基态钴原子的外围电子排布图(轨道表示式)为___________。
(2)常温下,噻吩是一种无色、有恶臭、能催泪的液体,天然存在于石油中。
①1mol噻吩(![]() )中含有的
)中含有的![]() 键数目为___。
键数目为___。
②在组成噻吩的三种元素中,电负性最小的是__(填元素符号,下同);与S元素位于同一周期的非金属元素第一电离能由大到小的顺序为_______________。
(3)已知沸点:H2O>H2Se>H2S,其原因 __________。
(4)H2S在空气中燃烧可生成SO2,SO2催化氧化后得到SO3。
①写出与SO2互为等电子体的分子和离子:___、___(各一种)。
②气态SO3以单分子形式存在,其分子的立体构型为_____;固态SO3形成三聚体环状结(如图1所示),该分子中S原子的杂化轨道类型为______。

(5)Na2S的晶胞结构如图2所示,则黑球代表的离子是___。已知Na![]() 的半径为0.102nm,S2-的半径为0.184nm,根据硬球接触模型,则Na2S的晶胞参数a=__nm(列出计算式即可)。
的半径为0.102nm,S2-的半径为0.184nm,根据硬球接触模型,则Na2S的晶胞参数a=__nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的CuCl2产品投入Na2CO3溶液中,充分反应后得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:
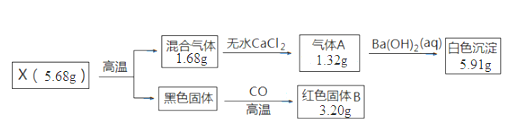
(1)混合气体的成分是__。
(2)X的化学式为__。
(3)写出CuCl2与Na2CO3反应生成X的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝是两种重要的金属,其单质及化合物在人们的日常生活、生产及科学研究中具有广泛的用途。回答下列问题:
(1)基态铝原子的电子排布图是____________________。
(2)与Al3+具有相同的电子层结构的简单阴离子有__________(填离子符号),其中形成这些阴离子的元素中,电负性最强的是__________(填元素符号,下同),第一电离能最小的是__________。
(3)Al、Cl的电负性如下表:
元素 | Al | Cl |
电负性 | 1.5 | 3.0 |
则AlCl3为________晶体(填晶体类型);AlCl3升华后蒸气的相对分子质量约为267,则该蒸气分子的结构式是____________(标明配位键)。
(4)氢化铝钠(NaAlH4)是重要的有机合成中还原剂。
①![]() 的空间构型为____________。
的空间构型为____________。
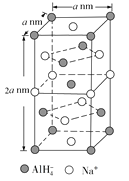
②NaAlH4的晶胞如下图所示,与Na+紧邻且等距的![]() 有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
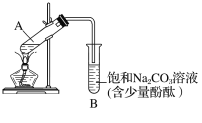
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄
B.下层液体红色变浅或变为无色
C.有气体产生
D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有__________、________、________、________,收集乙酸的适宜温度是_______________________________________。
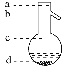
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1273K、100.0kPa条件下,乙烷生成乙烯的反应C2 H6(g)![]() C2 H4(g)+H2(g)达到平衡后
C2 H4(g)+H2(g)达到平衡后
A. C2 H6的浓度保持不变
B. C2 H6仍在不断分解,其浓度不断减小
C. C2 H6的分解速率大于生成速率
D. C2 H4仍在不断生成,其浓度不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )

下列说法正确的是( )
A.反应过程中NO2、NH4+之间的反应是氧化还原反应
B.上述历程的总反应可以为:2NH3+NO+NO2 2N2+3H2O
2N2+3H2O
C.X是HNO2,是还原产物
D.[(NH4)(HNO2)]+是反应过程中的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com