
【题目】(1)浓硫酸与木炭在加热条件下反应的化学方程式是___________________
(2)试用下图所列各种装置设计一个实验来验证上述反应所产生的各种产物。

这些装置的连接顺序,按产物气流从左到右的方向是(填装置的编号):
_________→________→________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是________________________________________,
C瓶溶液的作用是_________________________________________。
(4)装置②中所装的固体药品是_____________,可以验证的产物是_______
(5)装置③中所盛溶液是_______________,可以验证的产物是_____
【答案】 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O ④→②→①→③ 检验SO2的存在 检验SO2是否除尽 无水硫酸铜 水蒸气 澄清石灰水 CO2
CO2↑+2SO2↑+2H2O ④→②→①→③ 检验SO2的存在 检验SO2是否除尽 无水硫酸铜 水蒸气 澄清石灰水 CO2
【解析】(1)浓硫酸具有强氧化性,与木炭在加热条件下反应的化学方程式是C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验,所以其连接顺序是④→②→①→③;(3)根据以上分析可知A瓶溶液的作用是检验SO2;C瓶溶液的作用是检验SO2是否除尽;(4)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气,所以装置②中所装的固体药品是无水硫酸铜,也验证的产物是水蒸气;(5)二氧化碳能使澄清石灰水变浑浊,所以实验室用澄清石灰水检验二氧化碳,则装置③中所盛溶液是澄清石灰水。
CO2↑+2SO2↑+2H2O;(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验,所以其连接顺序是④→②→①→③;(3)根据以上分析可知A瓶溶液的作用是检验SO2;C瓶溶液的作用是检验SO2是否除尽;(4)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气,所以装置②中所装的固体药品是无水硫酸铜,也验证的产物是水蒸气;(5)二氧化碳能使澄清石灰水变浑浊,所以实验室用澄清石灰水检验二氧化碳,则装置③中所盛溶液是澄清石灰水。


科目:高中化学 来源: 题型:
【题目】下列有关物质的分类,正确的是( )
A. 烧碱、纯碱、熟石灰均属于碱
B. HCOOH、H2CO3、H2SO4均属于二元酸
C. 盐酸、BaSO4、NH3H2O均属于电解质
D. 酒精、冰水混合物、液氨均属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下元素均为短周期元素:
元素代号 | 相关信息 |
M | 非金属元素,其气态氢化物的水溶液呈碱性 |
A | A的单质与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是内层电子数的三倍 |
C | 在第三周期中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)B在周期表中的位置______,C离子的结构示意图_______。
(2)D的最低价含氧酸的电子式______。
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式____。(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:______。
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1molX、3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
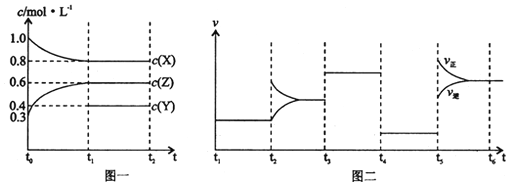
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g)ΔH<0
3Z(g)ΔH<0
C. 若t0=0,t1=10s,则t0-t1阶段的平均反应速率为v(z)=0.03mol/(L﹒s)
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;D和E的反应是化工生产中的一种重要的固氮反应。

请回答下列问题:
(1)H的化学式____________ ;F的电子式_________。
(2)D与E反应的化学反应方程式为_______________;I 与J反应的现象为___________________
(3)检验H中阳离子的方法是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生活中应用广泛。含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=_________(用△H1、△H2表示)。
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq) ![]() I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。

(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:____________。
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附____(填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
![]() AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com