
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
材料一、(见图)
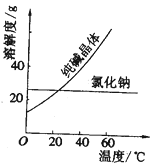
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
【答案】HNO3 CO32 Ba(NO3)2 SO42 AgNO3 Cl C A
【解析】
(1)检验SO42-,需使用Ba2+;检验CO32-,需使用H+;检验Cl-,需使用Ag+。
(3)从曲线图中可以看出,氯化钠和纯碱都是易溶于水的盐,二者的溶解度受温度的影响不同,可通过改变温度,将纯碱分离出来。
(4)乙二醇和丙三醇是沸点相差较大的两种有机物,可利用沸点的差异,将二者分离开来。
(1)由前面的分析可知,将SO42-、CO32-、Cl-分离开来,必须先检验CO32-,再检验SO42-,最后检验Cl-。
①先加入HNO3,检验CO32,故答案为:HNO3;CO32;
②然后加入Ba(NO3)2,检验SO42,故答案为:Ba(NO3)2;SO42;
③最后加入AgNO3,检验Cl,故答案为: AgNO3;Cl;
(2) ①从溶解度曲线看,氯化钠和纯碱的溶解度受温度影响不同,最好应用结晶法提取纯碱,故答案为:C;
②从表中数据看,乙二醇和丙三醇的沸点相差较大,可利用蒸馏法分离,故答案为:A。


科目:高中化学 来源: 题型:
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
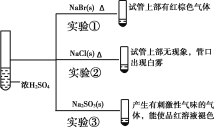
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验回答下列问题:
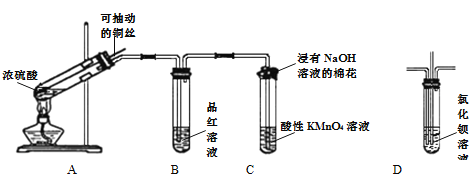
(1)装置A中试管内发生反应的化学方程式是_________________________________。
(2)根据装置B中的现象可以证明SO2具有__________性,反应一段时间后,将装置B中试管加热,可以观察到_______________________。
(3)装置C中试管口的棉花团上发生反应的离子方程式为________________________。
(4)如果将装置B换成装置D,并从直立导管中向氯化钡溶液中通入另一种气体,产生白色沉淀,则这种气体可能是_________________(填一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
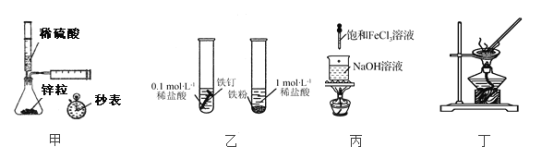
A. 用甲装置测定一定时间内产生氢气的体积,可测定该反应的速率
B. 用乙所示方法探究固体表面积对反应速率的影响
C. 用丙装置制备Fe(OH)3胶体
D. 用丁装置蒸发结晶制AlCl3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一稀硫酸和硝酸铁的混合溶液,向其中加入铁粉,溶液中的Fe2+浓度如图所示(不考虑溶液体积的变化):

(1)溶液中H2SO4与Fe(NO3)3的物质的量之比为_________
(2)请写出详细的计算过程_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体〔CH3CH(OH)COO〕2Fe·2H2O是一种很好的食品铁强化剂,可由乳酸钙与FeCl2反应制得,制备流程如下:
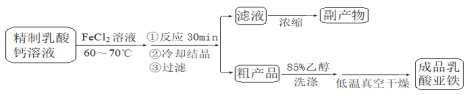
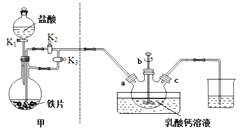
反应装置如下图所示:
已知:①潮湿的乳酸亚铁易被氧化
②物质的溶解性:
乳酸钙:溶于冷水,易溶于热水;乳酸亚铁:溶于冷水和热水,难溶于乙醇。
请回答:
(1)装置甲的气密性检查操作为_________
(2)部分实验操作过程如下,请按正确操作顺序填入字母,其正确的操作顺序是:检查气密性![]() 按图示要求加入试剂
按图示要求加入试剂![]() 将三颈烧瓶置于水浴中
将三颈烧瓶置于水浴中![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() 开动搅拌器
开动搅拌器![]() ……
……
a.关闭K1;
b.盖上分液漏斗上口玻璃塞;
c.关闭K3,打开K2;
d.关闭K2,打开K3;
e.打开分液漏斗上口玻璃塞;
f打开K1
(3)该装置制备乳酸亚铁的优点是_________副产物为_________
(4)下列说法正确的是_________
A.装置甲中的主要仪器是球形分液漏斗和蒸馏烧瓶
B.本实验采用较大铁片而不是铁粉的主要原因是控制反应速率,防止进入三颈烧瓶的氯化亚铁过多,反应过于剧烈
C.乳酸亚铁悬浊液应从b口倒出进行抽滤,并用滤液洗涤三颈烧瓶,将洗涤液倒入布氏漏斗再次抽滤
D.粗产品的洗涤液,经蒸馏后所得的残留液,与滤液混合可提高副产物的产量
(5)在实验过程中FeCl2溶液和乳酸钙溶液混合即出现浑浊,继续在60℃-70℃下反应30分钟,静置冷却、抽滤、洗涤、低温真空干燥,得到成品,经测定得到反应温度和成品中Fe3+含量关系如图,60℃之后Fe3+含量明显较低的可能的原因是_________
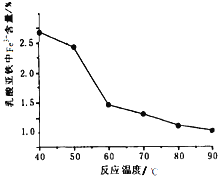
(6)有同学提出可直接用KMnO4滴定法测定样品中的Fe2+量进而计算纯度,但实验后发现结果总是大于100%,其主要原因可能是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.1mol /L 氢氧化钠溶液 100mL,现有 2mol /L 氢氧化 钠溶液。
(1)计算所需 2mol /L 氢氧化钠溶液的体积;_______________
(2)完全中和 50 mL 已配制溶液,需要 1mol/L 的盐酸多少体积?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,若A容器中充满气体O2和B容器中充满气体O3
(1)若所含分子总数相等,则A容器和B容器的容积之比是____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是___。
(3)若A容器和B容器的体积比为3∶2,则气体O2和气体O3质量之比为___,密度之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com